При попадании кислоты на кожу нужно нейтрализовать ее раствором соды, смыть водой.
Кислоты – это электролиты, которые при диссоциации образуют катионы водорода и анионы кислотных остатков.

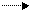 Например, HCl H+ + Cl –
Например, HCl H+ + Cl –
Классификация.
По составу кислоты бывают:
а)бескислородные – HCl – соляная H2S – сероводородная и т.д. б) кислородсодержащие– HNO3 – азотная, H2SO4 – серная, H3PO4 – ортофосфорная и т.д.
По числу атомов водорода, способных замещаться на металл: одноосновные – HCl, HNO3 (соляная, азотная), двухосновные– H2SO4 (серная), трехосновные – H3PO4 (ортофосфорная).
Физические свойства. Кислоты могут быть жидкими (например, HNO3, H2SO4, HClO4– азотная, серная, хлорная) и твердыми (например, H3PO4, H3BO3,H2SiO3.– ортофосфорная, борная, кремниевая). Многие кислоты хорошо растворимы в воде (кроме кремниевой). Растворы их имеют кислый вкус, разъедают растительные и животные ткани.
Химические свойства.С точки зрения ТЭД все общие характерные свойства кислот: изменение окраски индикатора, кислый вкус, взаимодействие с основными оксидами, основаниями, солями обусловлены катионами водорода H+.
· Изменяют цвет индикатора: в кислоте лакмус – красный, метилоранж – розовый.
· Взаимодействуют с основными оксидами:
Кислота + основной оксид = соль + вода CuO + H2SO4 = CuSO4 + H2O
Сульфат меди
· Взаимодействуют с основаниями:
Кислота + основание = соль + вода HCl + NaOH = NaCl + H2O
В ионном виде: H+ + Cl – + Na+ + OH – = Na+ + Cl – + H2O
H+ + OH – = H2O
· Взаимодействуют с солями:
Кислота + соль = новая кислота + новая соль H2SO4 + BaCl2 = BaSO4 ↓ + 2HCl
( если образуется осадок ↓или газ ↑) сульфат бария
В ионном виде: 2H+ + SO4 2– + Ba2+ + 2Cl – = BaSO4 ↓ + 2H+ + 2Cl –
Ba2+ + SO42– = BaSO4 ↓
2HCl + Na2CO3 = 2NaCl + H2O + CO2↑
Хлорид натрия
В ионном виде: 2H+ + 2Cl – + 2Na+ + CO3 2– = 2Na+ + 2Cl – + H2O + CO2 ↑
2H+ + CO3 2– = H2O + CO2 ↑
· Взаимодействуют с металлами:
Металл + кислота = соль + водород Fe + 2HCl = FeCl2 + H2↑
(металлы, стоящие в ряду напряжений хлорид железа (II)
до водорода, кислоты неокислители)
При попадании кислоты на кожу нужно нейтрализовать ее раствором соды, смыть водой.
Применение.1. Соляная кислота используется при паянии, при получении красок, пластмасс, лекарств, солей и т.д. 2. Азотная кислота применяется при получении серной кислоты, в производстве красителей, лекарств, фотопленки, взрывчатых веществ, удобрений, при получении «царской» водки и т.д.
3.Серная кислота используется в производстве красителей, взрывчатых веществ, лекарств, солей, минеральных удобрений. В машиностроении серной кислотой очищают поверхность металла от оксидов перед покрытием (никелированием, хромированием). Она широко используется в органическом синтезе , как электролит в аккумуляторах и т.д.
Д.И. Менделеев в «Основах химии » писал: «Едва найдется другое, искусственно добываемое вещество, столь часто применяемое в технике, как серная кислота. Там, где техническая деятельность развита, там потребляется и много серной кислоты».
| <== предыдущая лекция | | | следующая лекция ==> |
| Выбор и принятие решений при проектировании сложных систем. | | | Методы повышения надежности программного обеспечения |
Дата добавления: 2016-05-05; просмотров: 1543;
