Особенности аналитического этапа биоэквивалентных исследований генерических лекарственных средств.
Биоаналитическую часть испытаний биоэквивалентности следует проводить в соответствии с принципами надлежащей лабораторной практики (GLP). Для определения концентрации действующих веществ в плазме, сыворотке или цельной крови, а также моче могут быть использованы различные методы (физико-химические, иммунологические, микробиологические и др.), обеспечивающие возможность получения достоверных лабораторных данных о концентрации действующего вещества при выбранных условиях фармакокинетического исследования, в частности, его длительности, и отвечающие общим требованиям избирательности, точности, воспроизводимости. Если вследствие пресистемной элиминации лекарственного средства оно необнаруживается в крови в неизмененном состоянии и не обладает фармакологической активностью (пролекарство), необходимо определять концентрацию биологически активного метаболита.Чтобы получить достоверные результаты, которые могут быть удовлетворительно интерпретированы, биоаналитические методы, используемые для определения активной части действующего вещества и/или продукта (продуктов) его биотрансформации в плазме крови, сыворотке, крови или моче, или любом другом подходящем биоматериале, должны быть надлежащим образом охарактеризованы,полностью валидированы и документированы. Основная цель валидации метода –доказать надежность конкретного метода для количественного определения концентрации анализируемого вещества (веществ) в данном биологическом субстрате. К характеристикам биоаналитического метода, которые важны для обеспечения приемлемости его свойств и достоверности всех результатов анализа, относятся:
1)стабильность имеющихся растворов и анализируемого вещества (веществ) в биологическом субстрате в условиях обработки и в течение всего периода хранения;
2)специфичность;
3)правильность;
4)точность;
5)предел количественного определения и предел обнаружения;
6)линейный диапазон определяемых концентраций лекарственного вещества в
биожидкостях.
Валидация биоаналитического метода должна состоять из двух отдельных фаз:
1)фазы, предшествующей исследованию, в ходе которой проверяется соответствие метода количественного определения шести указанным выше характеристикам; и 2)фазы самого исследования, в ходе которой валидированный биоаналитический метод применяют для реального анализа проб биоисследования в основном для того, чтобы подтвердить стабильность, правильность и точность. Калибровочную кривую необходимо строить для каждого анализируемого вещества в каждой серии аналитических определений; ее необходимо использовать для вычисления концентрации анализируемого вещества в образцах с неизвестны содержанием в данной серии определений.
Для проверки достоверности количественного определения лекарства в образцах выполняют точечный контроль, который заключается в повторном определении концентрации лекарства как минимум в 3 образцах различной концентрации с целью окончательного принятия или отклонения результатов аналитического этапа.
Все процедуры следует выполнять в соответствии с предварительно установленными стандартными рабочими методиками (СОПы). Необходимо представить и обсудить все используемые для валидации биоаналитического метода процедуры и формулы, имеющие отношение к делу. Любое изменение биоаналитического метода перед анализом исследуемых образцов и во время его проведения может потребовать адекватной ревалидации; следует сообщать обо всех изменениях и обосновывать масштаб ревалидации. Исследования биоэквивалентности, представляемые в регистрационных досье на аналогичные по существу лекарственные препараты, которые содержат хиральные действующие вещества, должны быть проведены с использованием биоаналитических методов, специфичных в отношении энантиомеров. Исключение составляют случаи, когда
1)оба препарата содержат один и тот же стабильный одиночный энантиомер;
2)оба препарата содержат рацемат, и оба энантиомера характеризуются линейной
Фармакокинетикой
35. Связь между концентрацией лекарственного вещества в биологических жидкостях и его действием. Терапевтический мониторинг лекарственных средств.Как правило, по мере увеличения дозы (концентрации) лекарственного вещества его эффект возрастает. Вначале процесс прироста эффекта происходит пропорционально дозе лекарства, однако, процесс возрастания эффекта не носит бесконечного характера – обычно при достижении некоторого уровня прирост эффекта вначале уменьшается, а затем прекращается совсем и наступает фаза плато (т.е. дальнейшее увеличение дозы не приводит к возрастанию эффекта лекарства). Если представить эту зависимость изменения эффекта лекарства от его дозы графически, то она будет иметь вид экспоненциальной кривой. Предел эффекта, к которому стремиться кривая при бесконечном увеличении дозы лекарства называют максимальным эффектом (Emax). Зная Emax можно рассчитать, при какой дозе (концентрации) лекарства возникает эффект, равный половине максимального (½Emax или E50). Величину дозы или концентрации, вызывающей полумаксимальный эффект обозначают ED50 или ЕС50 соответственно. Таким образом: Еmax – максимальный эффект лекарства, который удается воспроизвести при введении в организм бесконечно больших количеств лекарства, ED50 или ЕС50 – доза или концентрация лекарства, при которой развивается эффект, равный половине от максимального. Однако, проводить анализ экспоненциальной кривой сложно, поэтому обычно прибегают к логарифмическому преобразованию координат. Если построить этот же график в полулогарифмических координатах, то он принимает вид S-образной кривой.
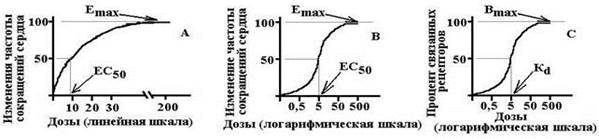
Схема 3. Градуальные кривые зависимости «доза-эффект». А – зависимость изменения частоты сердечных сокращений от дозы лекарства в нормальных координатах, В – та же кривая в полулогарифмических координатах (одна из шкал переведена в форму десятичных логарифмов), С – кривая связывания того же вещества с рецепторами миокарда.
Emax – максимальный эффект, Bmax – максимальное число связанных рецепторов, ЕС50 – концентрация лекарства при которой возникает эффект равный половине максимального, Kd – константа диссоциации вещества от рецептора, при которой связано 50% рецепторов. На основании построения таких кривых можно определить два важнейших показателя, характеризующих каждое лекарство: активность и эффективность. Активность (сила лекарства) – параметр, который показывает какая доза (концентрация) лекарства способна вызвать развитие стандартного эффекта, равного 50% от максимально возможного для этого лекарства. Т.е. активность лекарства численно характеризуется величиной ЕС50 или ED50. Чем выше активность лекарства, тем меньшая его доза требуется для воспроизведения терапевтического эффекта. Эффективность – это способность лекарства оказывать максимально возможное для него действие. Т.е. фактически это максимальная величина эффекта, которую можно достигнуть при введении данного лекарства. Эффективность численно характеризуется величиной Еmax. Чем выше Еmax, тем выше эффективность лекарства.
Терапевтический лекарственный мониторинг - контроль над концентрацией ЛС в плазме крови с целью подбора индивидуального режима дозирования препарата. Существует две основные предпосылки для проведения ТЛМ: повышение эффективности и безопасности фармакотерапии. Потребность в ТЛМ возникает в ситуациях, когда: ЛС обладает узкой терапевтической широтой; невозможно достичь терапевтического эффекта, используя известные схемы дозирования препарата; эффективность и безопасность препарата сложно оценить клиническими методами; содержание ЛС в крови достоверно коррелирует с эффектами препарата или способствует риску возникновения нежелательных лекарственных реакций; под влиянием индивидуальных особенностей пациента или патологии изменена фармакокинетика ЛС, снижена эффективность лечения или повышен риск нежелательных лекарственных реакций; препарат назначают длительный период времени.
Дата добавления: 2016-07-09; просмотров: 1600;
