КАРБОНАТЫ И ГИДРОКАРБОНАТЫ
а) К исп. образцу + воду, к-ту уксусную разведенную. Закрывают пробирку притертой пробкой со стеклянной трубкой, дважды изогнутой под прямым углом  наблюдается бурное выделение пузырьков газа без цвета и запаха. Пробирку осторожно нагревают и пропускают выделяющийся газ через р-р бария гидроксида; образуется белый осадок, растворяющийся при прибавлении избытка HCl: CO32− + 2CH3COOH → 2CH3COO− + H2O + CO2↑
наблюдается бурное выделение пузырьков газа без цвета и запаха. Пробирку осторожно нагревают и пропускают выделяющийся газ через р-р бария гидроксида; образуется белый осадок, растворяющийся при прибавлении избытка HCl: CO32− + 2CH3COOH → 2CH3COO− + H2O + CO2↑
Ca(OH)2 + CO2 → CaCO3↓ + H2O
b) Исп. образец растворяют в воде, + насыщенный р-р магния сульфата  образуется белый осадок (отличие от гидрокарбонатов, р-ры которых образуют осадок только при кипячении смеси):
образуется белый осадок (отличие от гидрокарбонатов, р-ры которых образуют осадок только при кипячении смеси):
4CO32− + 4MgSO4 + 4H2O →3MgCO3∙Mg(OH)2∙3H2O↓+ SO42− + CO2↑
2HCO3− → CO32− + H2O + CO2↑
с) Исп. образец растворяют в воде, + р-р фенолфталеина; появляется красное окрашивание (отличие от гидрокарбонатов, р-ры которых остаются бесцветными).
МЫШЬЯК
а) Р-р исп. образца нагревают на водяной бане с реактивом гипофосфита  образуется коричневый осадок.
образуется коричневый осадок.
b) Мышьяк (III) (арсениты). К р-ру исп. образца + HCl разведенную и р-р натрия сульфида 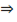 образуется желтый осадок, нерастворимый в HCl, растворимый в растворе аммиака: AsO33− + 6H+ ⇒ As3+ + 3H2O; 2As3+ + 3S2− ⇒ As2S3↓
образуется желтый осадок, нерастворимый в HCl, растворимый в растворе аммиака: AsO33− + 6H+ ⇒ As3+ + 3H2O; 2As3+ + 3S2− ⇒ As2S3↓
с) Мышьяк (V) (арсенаты). К р-ру исп. образца + р-р аммония хлорида, р-ра аммиака и р-ра магния сульфата  образуется белый кристаллический осадок, растворимый в HCl разведенной (отличие от арсенитов): AsO43− + Mg2+ + NH4+ ⇒ MgNH4AsO4↓
образуется белый кристаллический осадок, растворимый в HCl разведенной (отличие от арсенитов): AsO43− + Mg2+ + NH4+ ⇒ MgNH4AsO4↓
НИТРАТЫ
| а) Исп. образец прибавляют к смеси нитробензола кислоты серной, охлаждают в ледяной воде. + воду, р-р натрия гидроксида концентрированного, ацетон и взбалтывают; верхний слой приобретает темно-фиолетовую окраску: | 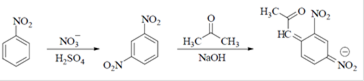
|
b) Р-р исп. образца не обесцвечивает р-р калия перманганата, подкисленный кислотой серной разведенной (отличие от нитритов).
Реакции идентификации неорганических анионов: нитриты, силикаты, сульфаты, сульфиты, фосфаты, хлориды.
НИТРИТЫ
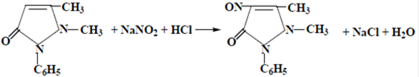
а) Несколько кристаллов антипирина растворяют в фарфоровой чашке в HCl разведенной + р-р исп. образца  появляется зеленое окрашивание: появляется зеленое окрашивание:
| 
|
b) К исп. образцу + H2SO4 разведенную  выделяются желто-бурые пары:
выделяются желто-бурые пары:
2NO2− + H2SO4 →NO↑+NO2↑ + H2O + SO42−
СИЛИКАТЫ
Исп. образец смешивают в свинцовом или платиновом тигле с помощью медной проволоки с натрия фторидом и несколькими каплями H2SO4 до образования суспензии. Тигель накрывают тонкой прозрачной пластиковой пластинкой с висящей каплей воды и осторожно нагревают  вокруг капли воды появляется белое кольцо: 2NaF+ H2SO4 →Na2SO4+2HF
вокруг капли воды появляется белое кольцо: 2NaF+ H2SO4 →Na2SO4+2HF
SiO2+6HF→H2[SiF6] +2H2O
СУЛЬФАТЫ
a) Исп. образец растворяют воде + HCl разведенную и р-р бария хлорида  образуется белый осадок: SO42− + BaCl2 → BaSO4↓ + 2Cl−
образуется белый осадок: SO42− + BaCl2 → BaSO4↓ + 2Cl−
b) К суспензии, полученной в результате реакции (а), прибавляют р-р йода; желтая окраска йода не исчезает (отличие от сульфитов и дитионитов), но обесцвечивается при прибавлении р-ра олова хлорида (отличие от йодатов). Смесь кипятят; осадок не окрашивается (отличие от селенатов и вольфраматов).
СУЛЬФИТЫ
а) К р-ру исп. образца + HCl разведенную и встряхивают; выделяется сернистый газ, обнаруживаемый по характерному резкому запаху: SO32− + 2HCl → 2Cl− + H2O +SO2↑
b) К р-ру исп. образца + р-р йода;  реактив обесцвечивается: SO32− + I2 + H2O → 2HI + SO42−
реактив обесцвечивается: SO32− + I2 + H2O → 2HI + SO42−
ФОСФАТЫ
а) К р-ру исп. образца + р-р серебра нитрата  образуется желтый осадок, цвет которого не изменяется при кипячении и который растворяется при прибавлении раствора аммиака:
образуется желтый осадок, цвет которого не изменяется при кипячении и который растворяется при прибавлении раствора аммиака:
3AgNO3 + PO43− → Ag3PO4↓ + 3NO3−
b) К р-ру исп. образца + молибденованадиевый реактив  появляется желтое окрашивание. Одна из возможных формул продукта взаимодействия фосфата с молибдено-ванадиевым реактивом имеет вид: (NH4)3PO4·NH4VO3∙16MoO3
появляется желтое окрашивание. Одна из возможных формул продукта взаимодействия фосфата с молибдено-ванадиевым реактивом имеет вид: (NH4)3PO4·NH4VO3∙16MoO3
с) К р-ру исп. образца + р-р аммония молибдата, нагревают  образуется желтый кристаллический осадок, растворимый в р-ре аммиака разведенного:
образуется желтый кристаллический осадок, растворимый в р-ре аммиака разведенного:
H3PO4+12(NH4)2MoO4+21HNO3 → (NH4)3PO4∙12 MoO3↓ +21NH4NO3+12H2O
(NH4)3PO412 MoO3 + 23NH4OH→12(NH4)2MoO4 + (NH4)2HPO4+11H2O
d) К р-ру исп. образца + р-р аммония хлорида, р-р аммиака разведенного и р-р магния сульфата  образуется белый кристаллический осадок, растворимый в разведенныхминеральных кислотах: MgSO4 + PO43− + NH4OH
образуется белый кристаллический осадок, растворимый в разведенныхминеральных кислотах: MgSO4 + PO43− + NH4OH 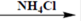 MgNH4PO4↓+SO42−+ H2O.
MgNH4PO4↓+SO42−+ H2O.
ХЛОРИДЫ
а) Исп. образец растворяют в воде, подкисляют кислотой азотной разведенной, + р-р серебра нитрата  образуется белый творожистый осадок, растворимый в р-ре аммиака:
образуется белый творожистый осадок, растворимый в р-ре аммиака:
Cl− + AgNO3 → AgCl↓+ NO3− AgCl + 2NH4OH→[Ag(NH3)2]Cl + 2H2O
b) Исп. образец помещают в пробирку, + калия дихромат и H2SO4. У входного отверстия пробирки помещают фильтровальную бумагу, пропитанную раствором дифенилкарбазида (пропитанная бумага не должна соприкасаться с калия дихроматом)  бумага окрашивается в фиолетово-красный цвет.Реакции идентификации органических анионов: ацетаты, бензоаты, лактаты, салицилаты, тартраты, цитраты
бумага окрашивается в фиолетово-красный цвет.Реакции идентификации органических анионов: ацетаты, бензоаты, лактаты, салицилаты, тартраты, цитраты
АЦЕТАТЫ
a) Исп. образец нагревают с к-той щавелевой  выделяется к-та уксусная, обнаруживаемая по запаху и кислой реакции: СН3СOONa + Н2С2O4→ СН3СOOН+NaH С2O4
выделяется к-та уксусная, обнаруживаемая по запаху и кислой реакции: СН3СOONa + Н2С2O4→ СН3СOOН+NaH С2O4
b) Исп. образец растворяют в воде, + р-р лантана нитрата, р-р йода и р-р аммиака разведенного. Нагревают до кипения  образуется синий осадок или появляется синее окрашивание.
образуется синий осадок или появляется синее окрашивание.
c) К р-ру исп. образца + р-р железа(III) хлорида  появляется красно-бурое окрашивание, исчезающее при прибавлении кислот минеральных разведенных:
появляется красно-бурое окрашивание, исчезающее при прибавлении кислот минеральных разведенных:
3СН3СOONa+FeCl3→(СH3COO)3Fe+3NaCl
d) К р-ру исп. образца + H2SO4 конц. Р и спирт, нагревают  образуется этилацетат, обнаруживаемый по запаху: СН3СOO− + Н+
образуется этилацетат, обнаруживаемый по запаху: СН3СOO− + Н+  СН3СOOН
СН3СOOН
СН3СOOН + С2Н5ОН → СН3СOOC2Н5 +Н2О
БЕНЗОАТЫ
а) К р-ру исп. образца + р-р железа (III) хлорида  образуется розовато-желтый осадок, растворимый в эфире: 3C6H5COO−+2Fe3++3H2O→(C6H5COO)3Fe∙Fe(OH)3↓+3H+
образуется розовато-желтый осадок, растворимый в эфире: 3C6H5COO−+2Fe3++3H2O→(C6H5COO)3Fe∙Fe(OH)3↓+3H+
b) Исп. образец помещают в пробирку + H2SO4, нагревают  на внутренних стенках пробирки появляется белый налет: C6H5COO−+ H2SO4+to→ C6H5COOH↓.
на внутренних стенках пробирки появляется белый налет: C6H5COO−+ H2SO4+to→ C6H5COOH↓.
с) Исп. образец растворяют в воде, + HCl  образуется осадок, имеющий температуру плавления от 120°С до 124°С: C6H5COO−+ HCl→ C6H5COOH↓.
образуется осадок, имеющий температуру плавления от 120°С до 124°С: C6H5COO−+ HCl→ C6H5COOH↓.
ЛАКТАТЫ
Исп. образец растворяют в воде, + бромную воду Р, H2SO4 разведенную и нагревают на водяной бане до обесцвечивания раствора. + р-р аммония сульфата, р-р натрия нитропруссида в H2SO4, р-р аммиака концентрированного  на границе двух жидкостей образуется темно-зеленое кольцо:
на границе двух жидкостей образуется темно-зеленое кольцо:
C3H6O3+Br2/H2O→CH3COCOOH→ to→HCOOH+CH3CHO+Na2[Fe(CN)5(NO)]
САЛИЦИЛАТЫ
а) К р-ру исп. образца + р-р железа (III) хлорида  появляется фиолетовое окрашивание, которое не исчезает после прибавления кислоты уксусной, но исчезает при прибавлении HCl разведенной; при этом образуется белый кристаллический осадок салициловой кислоты:
появляется фиолетовое окрашивание, которое не исчезает после прибавления кислоты уксусной, но исчезает при прибавлении HCl разведенной; при этом образуется белый кристаллический осадок салициловой кислоты:
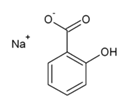 + FeCl3→ фиолет. окраш.
+ FeCl3→ фиолет. окраш.  + HCl →
+ HCl → 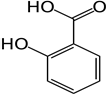
b) Исп. образец растворяют в воде, + HCl  образуется белый кристаллический осадок с температурой плавления от 156°С до 161°С.
образуется белый кристаллический осадок с температурой плавления от 156°С до 161°С.
ТАРТРАТЫ
а) Исп. образец растворяют в воде, + р-р железа (II) сульфата и р-р пероксида водорода разведенного  появляется неустойчивое желтое окрашивание. После обесцвечивания р-ра + р-р натрия гидроксида разведенный
появляется неустойчивое желтое окрашивание. После обесцвечивания р-ра + р-р натрия гидроксида разведенный  появляется интенсивное синее окрашивание.
появляется интенсивное синее окрашивание.
b) К р-ру исп. образца + р-р калия бромида , р-р резорцина, H2SO4  появляется темно-синееокрашивание. После охлаждения + воду; окраска р-ра изменяется на красную.
появляется темно-синееокрашивание. После охлаждения + воду; окраска р-ра изменяется на красную.
ЦИТРАТЫ
а) Исп. образец растворяют в воде, + H2SO4 и р-р калия перманганата, нагревают до обесцвечивания, + р-р натрия нитропруссида в H2SO4, к-ты сульфаминовой, р-р аммиака концентрированный до рН 7,0. Прибавление избытка р-ра аммиака концентрированногоР приводит к появлению фиолетового окрашивания, переходящего в фиолетово-синее.
b) К р-ру исп. образца + р-р кальция хлорида; р-р остаётся прозрачным; при кипячении раствора образуется белый осадок, растворимый в HCl разведенной:
−ООССН2 −С(ОН)(СОО−)−СН2СОО−+2Ca2+→(−ООССН2 −С(ОН)(СОО−)−СН2СОО−)2Ca
с) К исп. образцу + ангидрида уксусногоР и нагревают  появляется красное окрашивание.
появляется красное окрашивание.
63. Реакции идентификации функциональных групп: ацетил, амины ароматические первичные, эфиры сложные.
АЦЕТИЛ
Исп. образец помещают в пробирку, прибавляют к-ту фосфорную. Пробирку закрывают пробкой, через которую пропущена небольшая пробирка, содержащая воду и выполняющая роль холодильника. На внешнюю поверхность меньшей пробирки помещяют 1 каплю раствора лантана нитрата. Если субстанция относительно легко гидролизуется, устройство помещают в водяную баню, затем вынимают меньшую пробирку. Для трудно гидролизуемых субстанций смесь медленно нагревают на открытом пламени до кипения. Каплю снимают, смешивают на фарфоровой пластинке с раствором йода. На край капли наносят р-р аммиака разведённого  в месте соединения двух капель появляется синее окрашивание, которое усиливается и сохраняется в течение короткого промежутка времени. На первом этапе реакции происходит гидролиз с образованием уксусной кислоты и далее реакция протекает также как и реакция b на ацетаты: 2CH3COO–R + H+ → 2CH3COOH + H–R
в месте соединения двух капель появляется синее окрашивание, которое усиливается и сохраняется в течение короткого промежутка времени. На первом этапе реакции происходит гидролиз с образованием уксусной кислоты и далее реакция протекает также как и реакция b на ацетаты: 2CH3COO–R + H+ → 2CH3COOH + H–R
Дата добавления: 2016-07-09; просмотров: 1792;
