Катализаторы, ускоряющие скорость химической реакции называются
1) ингибиторы 3) антиоксиданты
2) инициаторы 4) окислители
10. Принято выделять следующие виды катализа:
1) гомогенный 3) мономолекулярный
2) гетерогенный 4) нулевой
11. В организме роль катализаторов выполняют:
1) жирные кислоты 3) ферменты
2) витамины 4) ДНК и РНК
12. При увеличении температуры на 50ºС скорость химической реакции возрастет в 32 раза. Чему равен температурный коэффициент реакции?
1) ¾ 2) 8×10-2 3) 2 4) 5,08
13. Реакция разложения Н2О2 в водном растворе протекает как реакция I-го порядка. Период полураспада составляет 15,86 мин. Какое время потребуется для разложения 99% взятого количества Н2О2 – ?
1) 11 часов 2) 1 сутки 3) 50 мин 34 сек 4) 106,96 мин
14. При 60ºС вещество «Х» подвергается термическому разложению по уравнению I-го порядка с константой скорости 0,05 мин-1. Сколько времени нужно нагревать раствор при 60ºС, чтобы исходная концентрация вещества равная 0,1 моль/л уменьшилась до 0,01 моль/л – ?
1) 34 сек 2) 1 час 58 мин 3) 46 мин 4) 2 сут
15. Порядок и молекулярность для простых реакций:
1) совпадают
2) молекулярность в 2 раза больше порядка реакции
3) порядок реакции в 1,5 раза больше молекулярности
4) это зависит от условий процесса
16. Вещество, изменяющее скорость химической реакции и остающееся после этого в неизменном состоянии и количестве называется …
1) промежуточным продуктом реакции 3) катализатором
2) восстановителем 4) продуктом реакции
17. К особенностям ферментативного катализа относят:
1) высокую избирательность 3) оптимальные значения рН и T
2) высокую каталитическую активность 4) верны все варианты
18. Уравнение Михаэлиса-Ментена имеет вид 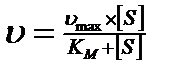 и характеризует:
и характеризует:
1) зависимость стационарной скорости ферментативной реакции от концентрации субстрата
2) соотношение между величиной константы Михаэлиса и концентрацией субстрата
3) оба утверждения верны
4) ни один из предложенных вариантов
19. Если температурный коэффициент скорости химической реакции равен 2, то при повышении температуры от 200С до 500С скорость реакции
1) увеличивается в 8 раз 3) увеличивается в 6 раз
2) уменьшается в 2 раза 4) уменьшается в 4 раза
Модуль № 2
Биологически активные неорганические соединения (строение, свойства, участие в функционировании живых систем). Физико-химия поверхностных явлений и свойства дисперсных систем
Занятие № 6
ТЕМА:Химия биогенных элементов. Элементы S - блока.
ЦЕЛЬ:Изучить химические свойства и биологическую роль макро- и микроэлементов.
Теоретические вопросы:
1. Биогенные элементы. Органогенные элементы и их роль в живой клетке. Металлы жизни.
2. Классификация химических элементов в организме по В.И. Вернадскому. Роль макро- и микроэлементов в живом организме. Концентрирование химических элементов в органах, тканях и биожидкостях человека. Эндемические заболевания.
3. Общая характеристика S- элементов. Валентные электроны. Изменение активности S-элементов в группе. Степень окисления. Щелочные металлы, их химические свойства. Особенности свойств лития. Оксиды, пероксиды, надпероксиды щелочных металлов. Биологическая роль натрия и калия. Натрий-калиевый насос. Соединения щелочных металлов, применяемых в медицине (NaCl, Li2CO3, NaHCO3, KCl, Na2SO4·10H2O).
4. S- элементы II A группы. Степени окисления. Тип гибридизации атомных орбиталей. Щелочноземельные элементы. Особенности свойств бериллия. Оксид и гидроксид кальция. Пероксид бария, сульфат бария. Их применение. Биологическая роль ионов магния и кальция. Антагонизм ионов магния и кальция. Соединения магния и кальция, применяемые в медицине (MgO, MgSO4, CaO, CaCl2, CaSO4·2H2O).
Дата добавления: 2016-06-24; просмотров: 1404;
