Вопрос 75. Основные причины, препятствующие развитию промышленного производства алюминия в нашем регионе.
стабильному росту алюминиевого рынка препятствует ряд проблем. Среди них особое внимание заслуживают следующие:
- несоответствие спроса и предложения;
- рост себестоимости производства алюминия;
- реконструкция имеющихся мощностей и развитие продленных технологий;
- отсутствие вторичного использования алюминия;
- недостаточный уровень развития ресурсной базы.
Вопрос 76. Молекула тетразина представляет собой молекулу бензола, где четыре атома углерода замешаны атомами азота. Нарисуйте наиболее вероятную структуру молекулы тетразина. Обоснуйте, почему «ароматичность» тетразина проявляется в значительной меньшей степени по сравнению с бензолом?
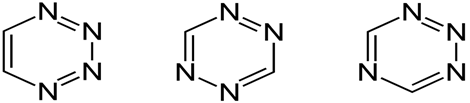
тетразины могут быть отнесены к ароматическим соединениям, однако значения энергии резонанса для этих структур ниже, чем для бензола.
Вопрос 77. Почему реакция сероводорода с сернистым газом ускоряется в присутствии паров воды?
Окисление сероводорода сернистым газом. Реакция протекает по
уравнению
SO2+2Н2S = 2Н2O + 3S + 55 ккал.
Эта реакция протекает самопроизвольно уже при обычных условиях и с заметной
скоростью в присутствии очень малых количеств воды, играющей роль катализатора.
Приведенная реакция лежит в основе образования в природе самородной серы; оба
участвующие в этой реакции газа обнаруживаются при извержении вулканов.
78. Как Вы думаете, могут ли некоторые соли быть жидкими при комнатной температуре?
Типичные соли - кристаллические вещества с ионной структурой, например CsF Существуют также ковалентные соли, например АlСl3. В действительности характер химической связи ,v многих солей смешанный.
При комнатной температуре соли быть жидкими не могут. Только будучи в растворе, то есть в химической смеси с какой-либо жидкостью. 100%ная соль не может быть в жидком состоянии.
79. В химический реактор, содержащий нагретую смесь газов O2 , SO2 и SO3 в состоянии химического равновесия, ввели некоторое количество аргона. Как изменится соотношение между компонентами равновесной смеси ?
80. Верны ли утверждения: a) «число водородных связей в льде меньше, чем в воде» ? б) «ближайшее координационное число одной молекулы H2O в воде меньше, чем в обычном льде»?
а) неверное утверждение. Наличие водородных связей и их кооперативные свойства, в частности, в воде приводит к тому, что её свойства изменяются в зависимости от количества водородных связей. Так, например, во льду водородных связей много, их количество уменьшается по мере того, как лед тает. В талой воде водородных связей – меньше, ещё меньше их в нагретой воде и практически нет – в воде кипящей. Если бы вода полностью лишилась возможности образовывать водородные связи, то превратилась бы в пар, конденсирующийся в жидкость при - 100 °С
Еще одна формулировка ответа:
Число водородных связей, наблюдаемых в данной массе воды, в большой степени зависит от температуры. Так, лед заключает наибольшее число водородных мостиков. При плавлении льда рвется около 15 % связей, при нагревании воды до 40 - около 50 % их. В парах воды водородных связей практически нет.
б) неверное утверждение. Т.к. при увеличении температуры воды (таяние льда) координационное число увеличивается. Для идеальной структуры льда это координационное число равно 4, что говорит о числе ближайших соседей данной молекулы. В то же время для жидкой воды, если пересчитать объем занимаемый молекулами для случая наиплотнейшей упаковки шаров, то среднее координационное число должно было быть 12. На самом деле для экспериментальных данных радиального распределения молекул, координационное число меняется в зависимости от температуры от 4,4 до 4,9. На основании этих данных можно сказать, что в воде существует некая ажурная каркасная конструкция из молекул, которая даже ориентировочно не напоминает плотноупакованную жидкость со средним координационным числом 12 под первым максимумом функции радиального распределения молекул, но, в то же время, она более плотная, чем во льду.
81. Почему аппарат Киппа не используют для получения сернистого газа?
82. Исходя из электронного строения комплексного иона , объясните, почему структура данного иона представляет собой искаженный октаэдр?
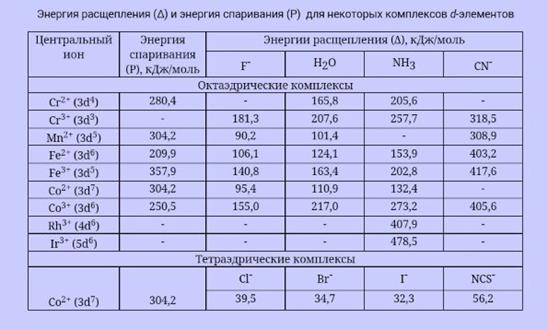


83. Экспериментально установлено, что длина связи в комплексе короче, чем в комплексном соединении . Используя метод молекулярных орбиталей, объясните данный факт.
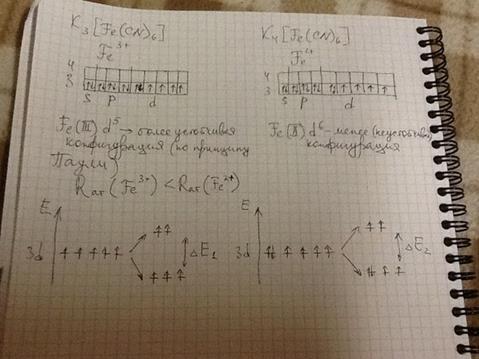
84. При взаимодействии водных растворов красной кровяной соли и FeCl3 выпал осадок синего цвета. Такой же эффект наблюдался при смешивании растворов FeSO4 и жёлтой кровяной соли. Напишите уравнения химических реакций, объясняющих эксперимент.
Ответ:
1. 3FeCl3 + K3[Fe(CN)6] =Fe3[Fe(CN)6] 2 + 3KCl
2. 4FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3+ 12KCl
85. В ёмкость с водным раствором, не содержащим «царскую водку», случайно уронили золотую цепочку. Через какое-то время цепочка полностью растворилась. Каков был возможный состав раствора и какая реакция могла при этом протекать?
Ответ: Это была селеновая кислота. Золото с легкостью растворится в селеновой кислоте: 2Au + 6H2SeO4 = Au2(SeO4)3 + 3SeO2 + 6H2O
86. Почему бронзовые памятники покрываются со временем зелёноватым налётом?
Стоит отметить, что зелёный налёт на памятниках - это и есть продукт коррозии, которую реставраторы называют патиной. Естественные патины делятся на «благородные» и «дикие». «Благородная» - плотная, она мало адсорбирует влагу из атмосферы. До середины XX века считалось, что «благородная» патина, покрывая поверхность памятника, полностью защищает его от дальнейшей коррозии. «Дикая» же патина - рыхлая, она поглощает много влаги из атмосферы, медь из поверхности памятника переходит в соли и окислы. Из-за этого поверхность с течением времени искажается и разрушается. Есть даже такое понятие как «бронзовая болезнь» или «рак меди», виной которому может стать «дикая» патина.
87. Нарисуйте все возможные изомеры комплексного иона [CrCl2(H2O)4]+.
88. Экспериментально обнаружено, что аквакомплекс [Сu(H2O)6]2+ характеризуется двумя различными значениями константы скорости лигандного обмена. Объясните эксперимент на основе электронной структуры аквакомплекса.
89. В чём специфика строения и свойств молекулы ферроцена?
Ферроцен (дициклопентадиенилжелезо) - металлорганическое соединение железа с пентагональной антипризматической «сэндвичевой» структурой. Благодаря своему высокосимметричному сэндвичевому строению, ферроцен обладает рядом интересных химических и физических свойств. Это соединение широко применяется в химии, биологии и фармакологии, как в промышленности, так и в научных исследованиях. Сам ферроцен и его производные хорошо растворимы в неполярных растворителях и практически нерастворимы в воде, соли же ферроцений-катиона в воде, напротив, растворяются. Ферроцен представляет собой оранжевые кристаллы с температурой плавления 173°С и кипения 249°С, плотностью 1.49 г/см3, растворимые в органических растворителях и нерастворимые в воде и возгоняющиеся при атмосферном давлении.
Сэндвичевая структура дициклопентадиенилжелеза была установлена в 1952 году на основании магнитных и спектральных свойств, а так же по рентгеноструктурным данным.
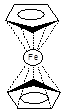
Молекула ферроцена неполярна, дипольный момент её практически равен нулю (0.05 D) и обладает диамагнетическими свойствами. ИК спектры показывают, что в соединении присутствуют С-Н связи только одного типа. Одинаковая ненасыщенность каждого атома углерода в циклопентадиенил-анионе показывает, что две таких частицы могут образовывать симметричные связи с ионом железа [1].
90. Что Вам известно о фазовых превращениях железа при нагревании ? Может ли железо-никелевое ядро Земли рассматриваться как источник её магнитного поля ?
Внимательно всмотревшись в излом металла, ясно можно увидеть, что он представляет собой нагромождение (совокупность) отдельных кристаллов (зерен), крепко сцепленных между собой. Мельчайшей частицей металла, как и всякого другого вещества, является атом. В элементарных ячейках, из которых состоят кристаллы железа, атомы расположены в определенном порядке. Это расположение изменяется в зависимости от температуры нагрева. При любой температуре ниже 910° атомы в ячейках кристаллов располагаются в виде куба, образуя так называемую кристаллическую решетку альфа-железа. В этом кубе восемь атомов расположены в углах решетки и один в центре.
При нагреве свыше 910° происходит перегруппировка атомов и кристаллическая решетка представляет собою форму куба с четырнадцатью атомами; условно ее называют решеткой гамма-железа. При температуре 1390° решетка гамма-железа перестраивается в решетку с девятью атомами, носящую название дельта-железо. Эта решетка отличается от решетки альфа-железа несколько большим расстоянием между центрами атомов и сохраняется до момента расплавления железа, т. е. до 1535° (Рис. 1).
Дата добавления: 2016-06-13; просмотров: 2268;
