ОСНОВНЫЕ КОНЦЕПЦИИ ХИМИИ
... совсем не глупо признать
материю активной..
П. Гассенди
Химия, которую Н.Лобачевский справедливо назвал «дочерью алхимии», изучает вещества и превращения их друг в друга. в XVII веке Р.Бойль положил начало современному представлению о химическом элементе как о простом теле, пределе химического разложения вещества, переходящем без изменения из состава одного сложного тела в другое. Интенсивно развиваться химия начала в XVIII веке, когда М.Ломоносов доказал закон сохранения масс в химических реакциях; А.Лавуазье - что в реакциях сохраняется не только масса соединения, но и массы его составляющих. При химических реакциях (явлениях превращения одних веществ в другие) не изменяется состав химических элементов и общее число атомов. Впервые это было сформулировано Дж.Дальтоном в 1803 г.: веса (массы) химических элементов, образующих различные соединения, относятся друг к другу как целые числа (объясняется атомистической теорией). В 1869 году Д.И.Менделеев составил таблицу химических элементов (тогда были известны 62 элемента), в которой отражалась связь периодического изменения свойств с изменением атомной массы. Химический элемент – простейшая атомно-молекулярная система, отвечающая за химические свойства вещества. (Сегодня в науке открыты и синтезированы 110 химических элементов, их содержание в природе крайне неравномерно – более 98 % массы верхних слоев Земли составляют восемь элементов: кислород (47%), кремний (27%), алюминий (9%), железо (5%), кальций (4%), натрий (3%), калий (2%), магний (2%); некоторые элементы могут быть получены только искусственным путем). В 1861 году А.М.Бутлеров предложил теорию химического строения вещества, которая и положила начало химии-науке.
Развитие химии все еще продолжается в виде узко ориентированных прикладных областей, но сегодня к ним добавились и концептуальные направления фундаментального характера. К числу основных концепцийсовременной химии следует отнести: учение о химической структуре веществ, учение о химических процессах и эволюционную химию.
Основная идея концепции А.М.Бутлерова является развитием атомистических представлений древних греков: энергия и способность вступать в химические реакции каждого атома или группы атомов в молекуле, легкость, с которой их можно заставить образовать новое соединение, зависят от пространственного расположения и от окружения этих атомов (это же и обуславливает и многие физические свойства: хрупкий графит и твердый алмаз состоят из углерода). Так в 60-80-е годы XIХ века возникла структурная химия, благодаря которой число изученных органических соединений за счет вновь синтезированных возросло с полумиллиона примерно до двух миллионов. Но структурная химия ограничена рамками сведений только о молекулах вещества, находящегося в дореакционном состоянии, она не объясняла, как управлять процессами превращения веществ (согласно ей могут быть вполне осуществимы многие реакции, которые на практике не идут). Решение этих проблем нашло учение о химических процессах. Но структурная химия остается важным разделом современной науки: большая часть лекарственных препаратов - продукты органического синтеза; современные «технологические рецепты» позволяют выращивать почти идеальные кристаллы (с огромной прочностью, термической стойкостью и др. свойствами), кристаллы с измененными электрическими, магнитными, оптическими и др. свойствами, получать сверхпрочные многослойные соединения и т.п.
Изучением реакционной способности веществ занимается химическая физика, основоположником которой считают Н.Н.Семенова. но еще Д.И.Менделеев показал, что свойства химического элемента зависят от места данного элемента в периодической системе, определяемого зарядом ядра атома. В XX веке физики помогли осознать особую роль внешнего электронного уровня атома - реакционная способность элемента зависит от количества электронов в нем. Наиболее активными с химической точки зрения являются элементы, имеющие минимальную атомную массу и 6-7 электронов на внешнем электронном уровне (F, Cl, O) - они стремятся достроить электронную оболочку, присоединив недостающее число электронов; а также элементы с большой атомной массой и 1-2 электронами на внешнем уровне (Ba, Cs), которые атом легко отдает для достраивания оболочек других атомов. На этом основано понятие валентности - способности атома к образованию химической связи.
Таким образом, реакционная способность веществ (их химическая активность) зависит от их строения. В химических реакциях разрушаются старые связи между атомами и образуются новые. Понятно, что нет связей, которые было бы невозможно разорвать. Почему же возможны не все реакции? Почему одни реакции обратимы, другие - нет? В самом общем виде методы управления химическими процессами можно подразделить на термодинамические и кинетические, а среди последних ведущую роль играют каталитические методы. Практически все химические реакции представляют собой не простое взаимодействие исходных веществ, а сложные цепи последовательных стадий, где реагенты взаимодействуют не только друг с другом, но и со стенками реактора (в котором протекает реакция), которые могут как ускорять (собственно катализировать), так и замедлять (ингибировать) процесс.
Для примера рассмотрим реакции образования-разложения воды, горения угля и разложения перекиси водорода:
обратимая реакция: реакция горения водорода в кислороде: 2H2 +O2 +Q0 ®2H2O+Q; Q>Q0; реакция разложения воды при электролизе: 2H2O +Q ® 2H2+O2+Q¢;Q>Q¢;
необратимая реакция: реакция горения угля: C+O2 +Q0 ®CO2+Q; Q>Q0;
самопроизвольная (и необратимая) реакция: реакция разложения перекиси водорода:2H2O2 ® 2H2O + O2;
Невозможность обратных реакций (образования перекиси водорода и выделения угля из углекислого газа) - результат действия I и II законов термодинамики (закона сохранения энергии и закона возрастания энтропии). Первый требует, чтобы энергия реагирующих веществ до реакции была больше, чем после. Второй - чтобы самопроизвольно в реакции возрастал беспорядок (уменьшалось количество связей у реагентов).
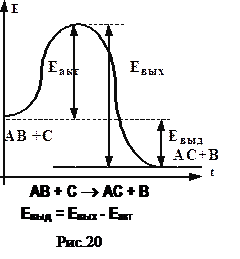 Первые реакции идут только при сообщении реагентам некоторого количества теплоты. При горении угля выделяется много энергии в виде тепла, то есть энергия углекислого газа меньше, чемС иО2 (кислородные связи – одни из самых высокоэнергетичных). Энтропия же убывает, но не самопроизвольно (есть начальное нагревание, Q0 ). При разложении перекиси водорода энтропия возрастает, так как H2O2 - более упорядочена, а больше связей - больше энергия соединения.
Первые реакции идут только при сообщении реагентам некоторого количества теплоты. При горении угля выделяется много энергии в виде тепла, то есть энергия углекислого газа меньше, чемС иО2 (кислородные связи – одни из самых высокоэнергетичных). Энтропия же убывает, но не самопроизвольно (есть начальное нагревание, Q0 ). При разложении перекиси водорода энтропия возрастает, так как H2O2 - более упорядочена, а больше связей - больше энергия соединения.
Закон сохранения энергии не позволяет всем веществам соединиться друг с другом (мир вернулся бы в хаос): существует некоторый энергетический барьер (определяемый количеством связей, порядком расположения атомов), только преодолев который вещества вступят в реакцию (рис.20). Преодолеть его можно двумя способами: при нагревании, при применении катализаторов. Если барьер низок - реакция протекает самопроизвольно, если высок – не начинается вообще.
Термодинамическое воздействие (увеличение температуры, давления и концентрации) влияет преимущественно на направленность химических процессов, а не на их скорость. Нагревание передает веществам энергию Еакт, необходимую для разрыва связей, называемую энергией активации. Ее значение определяется высотой энергетического барьера. Если энергия выхода Евых по модулю больше энергии активации - реакция идет с выделением тепла (экзотермическая), если меньше - с поглощением (эндотермическая). В случае обратимой реакции (2H2 +O2 « 2H2O+Q ) обратная реакция возможна лишь при сообщении достаточного количества теплоты, прямая - медленно течет и самопроизвольно. Как правило, прямая и обратная реакции протекают одновременно, только одна из них - более интенсивно.
Для управления химическим процессом в реагирующие вещества вносят те или иные добавки. Катализатор - вещество, ускоряющее прямую реакцию, выходит из нее без изменений (на поверхности катализатора увеличивается число встреч реагирующих молекул). Вообще, примеси могут оказывать как каталитическое, так и ингибиторное (сдерживающее) действие. Фактически катализатор снижает высоту энергетического барьера. Например, при взаимодействии веществ АС и В реакция не идет. Добавление катализатора К приводит к образованию нестойкого промежуточного соединения АК, которое имеет более низкий барьер с веществом В. Затем АК вступает в реакцию с В, в результате К выделяется в чистом виде и может использоваться снова:
АС + В + К ® АК + С + В ® АВ + С + К
Катализ широко применяется в промышленности (производство многих пищевых продуктов, горюче-смазочных материалов), все биохимические процессы в живой клетке протекают с участием катализаторов - ферментов. Химики говорят, что некаталитических процессов вообще не существует, поскольку материал стенок реакторов служит своеобразным катализатором.
Эволюционная химия (предбиология) - наука о самоорганизации и развитии химических систем - возникла во второй половине ХХ веке в связи с исследования биокатализаторов, хотя первые шаги в этом направлении были сделаны еще Я.Берцелиусом (ХVIII в.) и Л.Пастером (ХIХ в.). Живые организмы из блоков собрать нельзя, они возникли в ходе естественной эволюции от неорганических соединений к органическим и далее - к живым системам. Исследования в этой области привели к возможности решать новые эволюционные проблемы - самопроизвольного (без участия человека) синтеза новых химических соединений, более высокоорганизованных, чем исходные вещества.
В настоящее время химической науке известно около 8 млн. химических соединений, подавляющее большинство (96%) составляют органические соединения, включающие порядка 20 элементов; из остальных (около 100) химических элементов составлены всего 300 тысяч неорганических соединений. Из органогенов на Земле наиболее распространены кислород и водород, в космосе основную часть представляют два элемента - водород и гелий, более тяжелые встречаются крайне редко. Органоген номер один – углерод (он способен образовывать прочные, энергоемкие и, главное, разнообразные химические связи. Основу жизнедеятельности организмов обеспечивает только шесть химических элементов - углерод, водород, кислород, азот, фосфор и сера (составляют более 97%), за ними следуют: натрий, калий, кальций, магний, алюминий, железо, кремний, хлор, медь, цинк, кобальт, никель (1,6%), еще 20 элементов содержатся количестве порядка 1%.
В процессе биохимической эволюции шел тщательный отбор химических соединений: из миллионов органических соединений в построении живого участвуют лишь несколько сотен, из 100 известных аминокислот в состав белков входит только 20, четыре нуклеотида лежат в основе всех сложных полимерных нуклеиновых кислот, ответственных за наследственность и регуляцию процессов в живых организмах. А.П.Руденко сформулировал основной закон химической эволюции (1964 г.): с наибольшей скоростью и вероятностью реализуются те пути эволюционных изменений катализатора, на которых происходит максимальное увеличение его абсолютной активности и селективности действия катализаторов-ферментов.
Дата добавления: 2016-05-25; просмотров: 5811;
