Жидкое состояние вещества
Жидкое состояние, являясь промежуточным между твердым и газообразным, обладает свойствами газа и твердого тела. Область существования жидкости со стороны низких температур ограничена переходом в твердое, а со стороны высоких — в газообразное состояние. Изменение температуры жидкости, ее плотности соответственно приближает ее свойства к свойствам газов или твердых тел.
Так, уравнение Ван-дер-Ваальса (16.17) не только описывает реальный газ, но и, качественно, некоторые свойства жидкостей.
На рис. 21.1 изображены несколько изотерм, соответствующих температурам T1<T2<TK<T, уравнения (16.17) и отмечены области существования газа и жидкости. Как видно, с повышением температуры «горбатые участки» изотерм, соответствующие переходу жидкость — пар, сокращаются и при критической температуре Тк вырождаются в точку перегиба k. При температурах выше критической образование жидкости невозможно, вещество может существовать только в газообразной фазе.
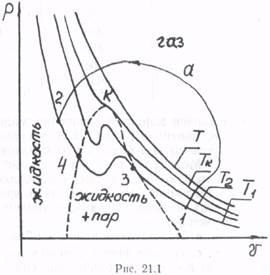
Вблизи критической температуры исчезает различие между паром и жидкостью. Действительно, как видно из рис. 21.1, возможен непрерывный переход (помимо изотермического сжатия 1—3—4—2) из газообразного состояния 1, взятого при температуре ниже критической, в жидкое состояние 4 в обход критической точки k произвольным процессом 1—а—2, минуя стадию существования двух фаз (жидкость— пар). Возможность такого перехода подчеркивает, что между жидкостью и газом нет принципиального качественного различия. С другой стороны, плотность жидкости примерно в 103 раз больше плотности газа. Соответственно концентрация молекул жидкости 1020...1021 см -3 приближается к концентрации твердого тела 1022... 1023 см -3.
Сравнение энергии взаимодействия молекул, находящихся в различных фазах, показывает, что при переходе жидкости в пар силы взаимодействия меняются значительно больше, чем при переходе кристалла в жидкость. В качестве иллюстрации приведена табл. 20.1 значений теплоты плавления qпл и теплоты испарения qиc для некоторых веществ при атмосферном давлении, из которой видно, что теплота плавления в десятки раз меньше теплоты парообразования.
Таблица 20.1
| Вещество | qпл,Дж/моль | qис, Дж/моль |
| Цинк Свинец Вода Этиловый спирт Кислород |
Существенно различен характер движения молекул газа, где они непрерывно, хаотично движутся, и твердого тела, в котором молекулы только колеблются около узлов кристаллической решетки. Молекулы жидкости, согласно теории Я. И. Френкеля, большую часть времени колеблются с частотами 102...1013 Гц около фиксированных в пространстве положений равновесия и лишь изредка, «скачком», меняют свое «место жительства».
Время пребывания молекулы жидкости вблизи данного центра колебания, т. е. среднее время 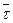 между двумя последовательными скачками, — время релаксации, сильно зависит от температуры. При высоких температурах, приближающихся к критической, время релаксации
между двумя последовательными скачками, — время релаксации, сильно зависит от температуры. При высоких температурах, приближающихся к критической, время релаксации 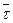 порядка 10-6 с, при низких температурах
порядка 10-6 с, при низких температурах 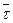 достигает значительных величин.
достигает значительных величин.
Непосредственные «соседи» каждой молекулы расположены более или менее закономерно, образуя подобие кристаллической решетки, далее этот порядок нарушается. Поэтому говорят, что жидкостям присущ только ближний порядок в отличие от кристаллических тел, характеризующихся еще и дальним порядком. Рентгенограммы подтверждают наличие в жидкостях множества микрообластей (размером 10-7 ... 10-8 см), в которых молекулы расположены закономерно. В каждое мгновение ∆t (∆t≤ 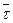 ) жидкость как бы состоит из множества кристаллов, различным образом ориентированных друг относительно друга. Тепловое движение приводит к тому, что в последующий момент времени картина меняется: меняются центры кристалликов, их взаимная ориентация.
) жидкость как бы состоит из множества кристаллов, различным образом ориентированных друг относительно друга. Тепловое движение приводит к тому, что в последующий момент времени картина меняется: меняются центры кристалликов, их взаимная ориентация.
Дата добавления: 2016-05-25; просмотров: 779;
