Реакции металлов с водой
Эти реакции тоже принадлежат к типу реакций замещения. Они сопровождаются вытеснением из воды водорода в газообразном состоянии. В качестве примера приведем реакцию между металлическим натрием и водой:
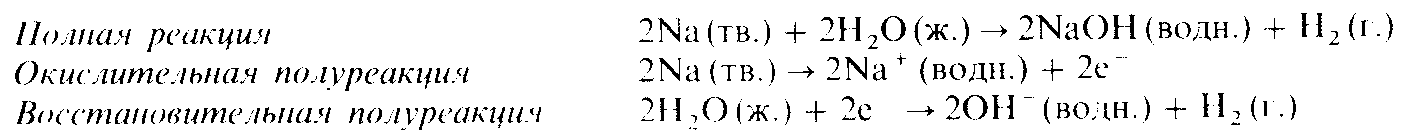
Реакции металлов с неметаллами
Эти реакции могут быть отнесены к реакциям синтеза. В качестве примера приведем образование хлорида натрия в результате сгорания натрия в атмосфере хлора
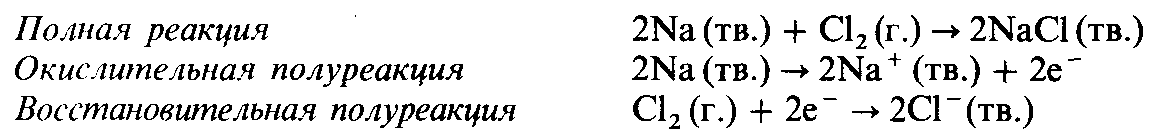
Билет № 20


Билет №21.
Железо, положение в периодической системе, строение атома, возможные степени окисления, физические свойства, взаимодействие с кислородом, галогенами, растворами кислот и солей. Сплавы железа. Роль железа в современной технике.
Железо находится в побочной подгруппе VIII группы периодической системы. Электронная формула атома железа:
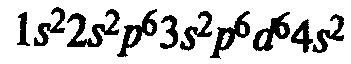
Типичные степени окисления железа +2 и +3. Степень окисления +2 проявляется за счет потери двух 4s-электронов. Степень окисления +3 соответствует также при потере еще одного Зd-электрона, при этом Зd-уровень оказывается заполненным наполовину; такие электронные конфигурации относительно устойчивы.
Физические свойства. Железо – типичный металл, образует металлическую кристаллическую решетку. Железо проводит электрический ток, довольно тугоплавко, температура плавления 1539°С. От большинства других металлов железо отличается способностью намагничиваться.
Химические свойства. Железо реагирует со многими неметаллами:
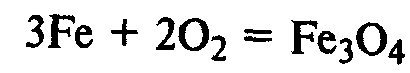
Образуется железная окалина – смешанный оксид железа. Его формулу записывают также так: FeО•Fe2О3.
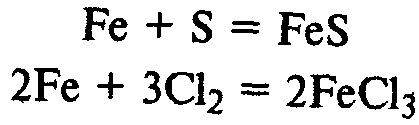
Реагирует с кислотами с выделением водорода:
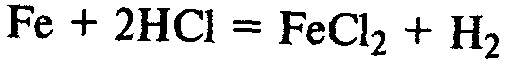
Вступает в реакции замещения с солями металлов, расположенных правее железа в ряду напряжений:
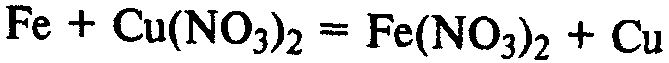
Соединения железа. FeО — основной оксид, реагирует с растворами кислот с образованием солей железа (II). Fe2О3 — амфотерный оксид, реагирует также с рас творами щелочей.
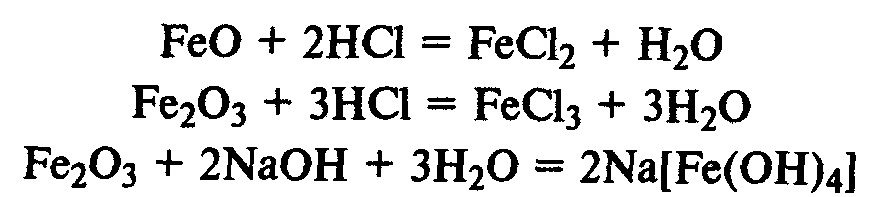
Гидроксиды железа. Fe(ОН)2 — типичный основной оксид, Fe(ОН)3 обладает амфотерными свойствами, реагирует не только с кислотами, но и с концентрированными растворами щелочей.
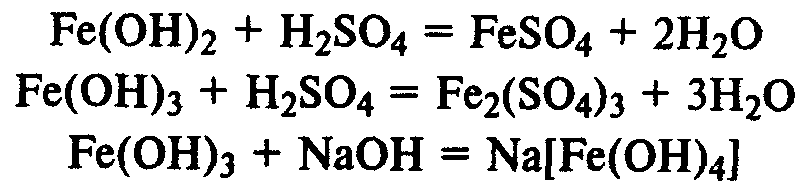
Гидроксид железа (II) легко окисляется до гидроксида железа (III) кислородом воздуха:
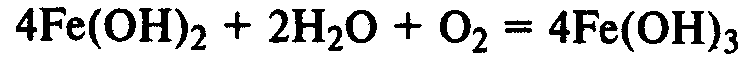
При реакции солей железа (II) и (III) со щелочами в осадок выпадают нерастворимые гидроксиды:

Сплавы железа. Современная металлургическая промышленность производит железные сплавы разнообразного состава.
Все железные сплавы разделяются по составу и свойствам на две группы. К первой группе относятся различные сорта чугуна, ко второй — различные сорта стали.
Чугун хрупок; стали же пластичны, их можно ковать, прокаты^ вать, волочить, штамповать. Различие в механических свойствах чугунов и сталей зависит прежде всего от содержания в них углерода — в чугунах содержится около 4% углерода, а в сталях — обычно менее 1,4%.
В современной металлургии из железных руд получают сначала чугун, а затем из чугуна — сталь. Чугун выплавляют в доменных печах, сталь варят в сталеплавильных печах. До 90% всего выплавленного чугуна перерабатывают в стали.
Чугун. Чугун, предназначенный для переработки в сталь, называют передельным чугуном. Он содержит от 3,9 до 4,3% С, 0,3—1,5% Si, 1,5—3,5% Мn, не более 0,3% Р и не более 0,07% S. Чугун, предназначенный'для получения отливок, называется литейным чугуном, В доменных печах выплавляются также ферросплавы, применяемые преимущественно в производстве сталей в качестве добавок. Ферросплавы имеют, по сравнению с передельным чугуном, повышенное содержание кремния (ферросилиций), марганца (ферромарганец), хрома (феррохром) и других элементов.
Стали. Все стали делятся на углеродистые и легированные.
Углеродистые стали содержат в несколько раз меньше углерода, кремния и марганца, чем чугун, а фосфора и серы совсем мало. Свойства углеродистой стали зависят прежде всего от содержания в ней углерода: чем больше в стали углерода, тем она твёрже. Промышленность производит мягкие стали, стали средней твёрдости и твёрдые. Мягкие стали и стали средней твёрдости применяются для изготовления деталей машин, труб, болтов, гвоздей и т. д., а твёрдые стали—для изготовления инструментов.
В сталях должно быть возможно меньше серы и фосфора, так как эти примеси ухудшают механические свойства сталей. В повышенных количествах сера вызывает красноломкость — образование трещин при горячей механической обработке металла. Фосфор вызывает хладноломкость—хрупкость стали при обыкновенной температуре. -
Легированные стали. Физические, химические и механические свойства сталей существенно изменяются от введения в их состав повышенного количества марганца и кремния, а также хрома, никеля, вольфрама и других элементов. Эти элементы называются легирующими, а стали — легированными [от латинского слова ligare – связывать, соединять].
Наиболее широко в качестве легирующего элемента применяется хром. Особенно большое значение для сооружения машин, аппаратов и многих деталей машин имеют хромоникелевые стали. Эти стали обладают высокой пластичностью, прочностью, жаростойкостью и стойкостью к действию окислителей. Азотная кислота любой концентрации не разрушает их даже при температурах кипения. Хромоникелевые стали не ржавеют в атмосферных условиях и в воде. Блестящие, серебристого цвета, листы хромоникелевой стали украшают арки станции «Маяковская» Московского метро. Из этой же стали делают нержавеющие ножи, ложки, вилки и другие предметы домашнего обихода.
Молибден и ванадий повышают твёрдость и прочность сталей при повышенных температурах и давлениях. Так, хромомолибденовые и хромованадиевые стали применяются для изготовления трубопроводов и деталей компрессоров в производстве синтетического аммиака, авиационных моторов.
При резании с большой скоростью инструмент сильно разогревается и быстро изнашивается. При добавлении вольфрама твёрдость стали сохраняется и при повышенных температурах. Поэтому хромовольфрамовые стали применяются для изготовления режущих инструментов, работающих при больших скоростях '
Увеличение содержания в стали марганца повышает её сопротивление трению и удару. Марганцовистые стали применяются для изготовления железнодорожных скатов, стрелок, крестовин, камнедробильных машин.
Применение легированных сталей позволяет значительно снизить вес металлических конструкций, повысить их прочность, долговечность и надёжность в эксплуатации.
Билет № 22
Итак, первая стадия – это обжиг пирита. Для увеличения площади соприкосновения пирита с кислородом воздуха пирит измельчают, учитывая, что при повышении температуры выше 800 градусов по Цельсию происходит спекание частиц. Чтобы предотвратить это применяют принцип противотока: измельченный пирит подают сверху, а воздух снизу. В результате частицы пирита разрыхляются, образуя при этом «кипящий слой».
Обжиг пирита идет по уравнению: 4FeS2 +11 O2 = 2Fe2O3 + 8SO2 +Q
Эта реакция экзотермическая, идет с выделением тепла, а как было сказано, температура в печи не должна превышать 800 градусов по Цельсию, поэтому избыточную температуру отводят, для этого вокруг печи проходят трубы с холодной водой.
Вторая стадия. Образовавшийся в печи оксид серы (IV) очищается от примесей пыли и водяных паров. В аппарате «Циклон» под действием центробежной силы газ очищается от крупной пыли, в электрофильтре газ очищается от мелких частиц.
Далее газ необходимо очистить от водяных паров. Это происходит в сушильной башне. Здесь используется принцип противотока.
Образовавшийся и очищенный оксид серы (IV) подается в контактный аппарат. Туда же подается воздух. Для начала этой реакции газовую смесь необходимо нагреть до 400 – 420 градусов по Цельсию, для этого перед контактным аппаратом необходим теплообменник. Горячий оксид серы (VI) из контактного аппарата отдает тепло газовой смеси ( смесь оксида серы (IV) и воздуха). В контактном аппарате присутствует катализатор – оксид ванадия (V). Катализатор увеличивает скорость этой реакции, но на смещение химического равновесия не влияет. 2SO2 + O2 = 2SO3
Последняя – третья стадия производства серной кислоты: образовавшийся в контактом аппарате оксид серы (VI) реагирует с водой , образует серную кислоту. Уравнение реакции: SO3 + H2O = H2SO4 - скорость реакции велика и ведет к тому, что образуется «туман», который чрезвычайно трудно уловить, он поступает в атмосферу, отравляя окружающую среду. Поэтому поглощение оксида серы (VI) ведут серной кислотой, концентрация которой 98,33%, при температуре 60 градусов по Цельсию. Раствор оксида серы (VI) в серной кислоте называют олеумом. Получившийся олеум транспортируется на склад.
Билет №24.
Дата добавления: 2016-05-11; просмотров: 3720;
