Общие способы получения металлов.
Металлы находятся в природе преимущественно в виде соединений. Только металлы с малой химической активностью (благородные металлы) встречаются в природе в свободном состоянии (платиновые металлы, золото, медь, серебро, ртуть). Из конструкционных металлов в достаточном количестве имеются в природе в виде соединений лишь железо, алюминий, магний. Они образуют мощные залежи месторождений относительно богатых руд. Это облегчает их добычу в больших масштабах.
Поскольку металлы в соединениях находятся в окисленном состоянии (имеют положительную степень окисления), то получение их в свободном состоянии сводится к процессу восстановления:

Этот процесс можно осуществить химическим или электрохимическим путем.
При химическом восстановлении в качестве восстановителя чаще всего применяют уголь или оксид углерода (II), а также водород, активные металлы, кремний. С помощью оксида углерода (II) получают железо (в доменном процессе), многие цветные металлы (олово, свинец, цинк и др.):
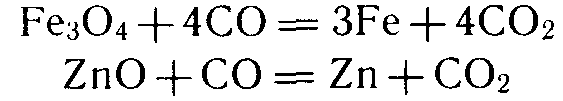
Восстановление водородом используется, например, для получения вольфрама из оксида вольфрама (VI):
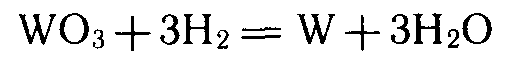
Применение в качестве восстановителя водорода обеспечивает наибольшую чистоту получаемого металла. Водород используют для получения очень чистого железа, меди, никеля и других металлов.
Способ получения металлов, в котором в качестве восстановителя применяют металлы, называют металлотермическим. В этом способе в качестве восстановителя используют активные металлы. Примеры металлотермических реакций:
алюминотермия:
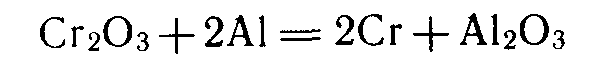
магниетермия:
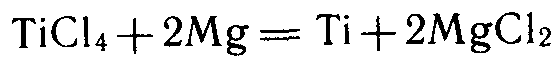
Металлотермические опыты получения металлов впервые осуществил русский ученый Н. Н. Бекетов в XIX в.
Металлы наиболее часто получают восстановлением их оксидов, которые в свою очередь выделяют из соответствующей природной руды. Если исходной рудой являются сульфидные минералы, то последние подвергают окислительному обжигу например:
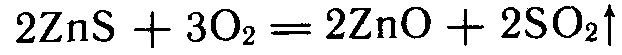
Электрохимическое получение металлов осуществляется при электролизе расплавов соответствующих соединений. Таким путем получают наиболее активные металлы, щелочные и щелочноземельные металлы, алюминий, магний.
Электрохимическое восстановление применяют также для рафинирования (очистки) «сырых» металлов (меди, никеля, цинка и др.), полученных другими способами. При электролитическом рафинировании в качестве анода используют «черновой» (с примесями) металл, в качестве электролита — раствор соединений данного металла.
Способы получения металлов, осуществляемые при высоких температурах, называют пирометаллургическими (по-гречески pyr — огонь). Многие из этих способов известны с древних времен. На рубеже XIX—XX вв. начинают развиваться гидрометаллургические способы получения металлов (по-гречески hydor—вода). При этих способах компоненты руды переводят в водный раствор и далее выделяют металл электролитическим или химическим восстановлением. Так получают, например, медь. Медную руду, содержащую оксид меди (II) CuО, обрабатывают разбавленной серной кислотой:
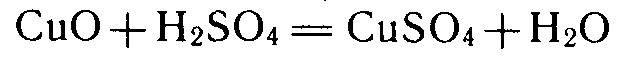
Для восстановления меди полученный раствор сульфата меди (II) либо подвергают электролизу, либо действуют на раствор порошком железа.
Гидрометаллургический способ имеет большое будущее, так как позволяет получать продукт, не извлекая руду из земли. (Сравните достоинства гидрометаллургического способа получения металлов с подземной газификацией угля.)
Ответы на вопрос № 2
1)Уравнение реакции:
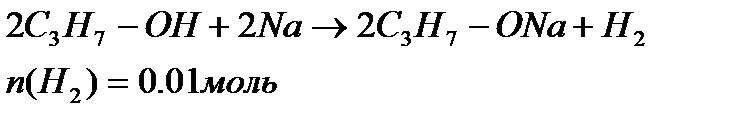
По уравнению 1 моль 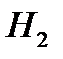 образуется из 2-х моль спирта
образуется из 2-х моль спирта
1 моль 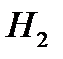 _________________ 2 моль
_________________ 2 моль 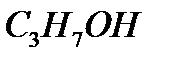
0,01 моль 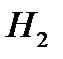 __________________
__________________ 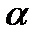 моль
моль 
Х= 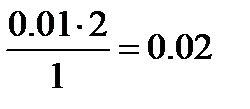 моль
моль
Находим сумму спирта.
m=n  M M(
M M( 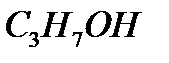 )=60
)=60 
m( 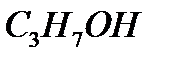 )=0.02 моль. 60
)=0.02 моль. 60 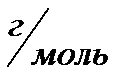 =1.2г
=1.2г
2)а) Гидроксид натрия определяет с помощью индикатора (лакмус).
В растворе NaOH 
 +
+ 
 лакмус синеет
лакмус синеет
б) Хлорид натрия определяется с помощью нитрата серебра:
 +NaCl= AgCl↓+
+NaCl= AgCl↓+ 
Выпадает белый осадок
в) Сульфат натрия определяем с помощью раствора  :
:
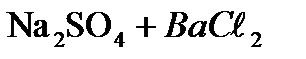 =
= 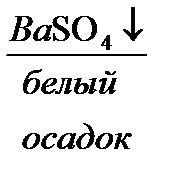 +2
+2 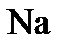
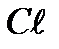
Выпадает белый осадок.
3)Уравнение реакции:
2Na+2 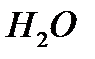
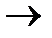 2NaOH+
2NaOH+ 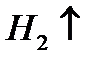
По уравнению 1 моль Na образует 1 моль 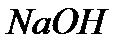
n(NaOH)=n(Na)=0.1 моль
m(NaOH)=n  M M(NaOH)=40
M M(NaOH)=40 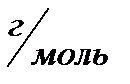
m(NaOH)=0.1  40=4г
40=4г
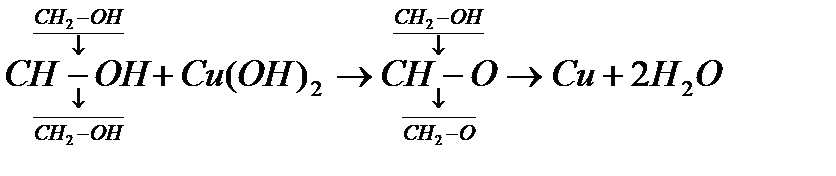
4)а) Глицерин многоатомный спирт. Определяется с помощью свежеприготовленного гидроксида меди 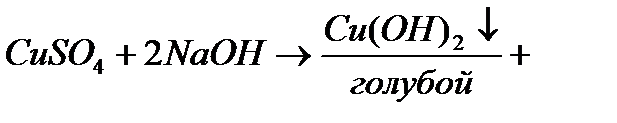 Na
Na 
К этому голубому осадку добавляем раствор глицерина. При этом осадок растворяется и появляется
ярко-синего цвета раствор.
б) Крахмал определяем с помощью йода:
Крахмал J 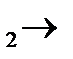 синие окрашивание.
синие окрашивание.
в) Белок можно определить с 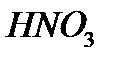
Белок + HNO3 = желтое окрашивание
5)Уравнение реакции: 2 H2S + 3O2 = 2SO2 + 2H2O
Vm=22.4 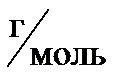
2 . 22,4 л 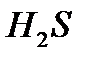 ____________3
____________3  22,4л
22,4л 
7л ____________ хл
Х= 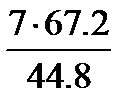 =10.5л
=10.5л
6) 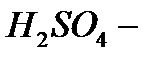 серная кислота:
серная кислота:
а) Диссоциация: 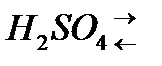 2H
2H 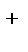 +SO
+SO 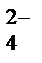
б) С металлами: Zn+H 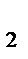 SO
SO 
 Zn SO
Zn SO  +H
+H 
в) С основными оксидами: ZnO+ H  SO
SO 
 Zn SO
Zn SO  +H
+H 
г) С основаниями: 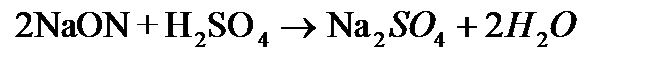
д) С солями: 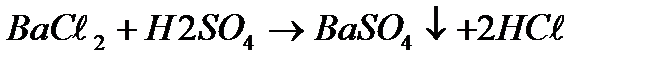
7) Уравнение реакции:
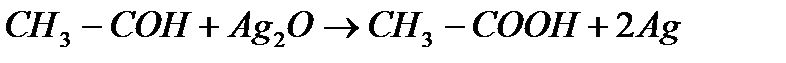 n(
n( 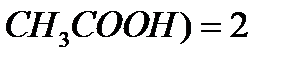 моль
моль
Уксусный альдегид Уксусная кислота
По уравнению 1 моль уксусный альдегид образует 1 моль уксусной кислоты.
Поэтому n( 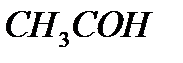 )=n(
)=n( 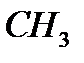 COOH)=2 моль
COOH)=2 моль
M( 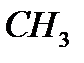 COH)=n
COH)=n  M M(
M M( 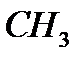 COH)=44
COH)=44 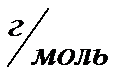
M( 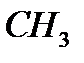 COH)= 2 моль
COH)= 2 моль 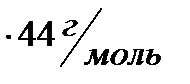 =88г.
=88г.
8) По правилу Вант-Гоффа:

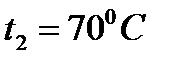
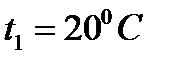
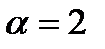
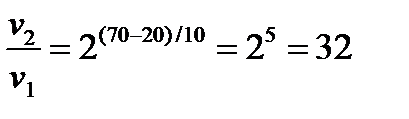 Ответ: возрастает в 32 раза
Ответ: возрастает в 32 раза
9) уравнение реакций :
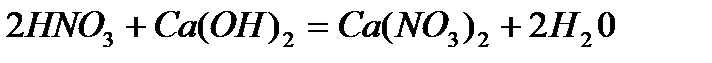
Вычисляем количество вещества реагирующих веществ –n:
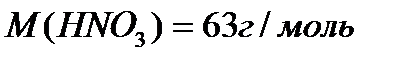
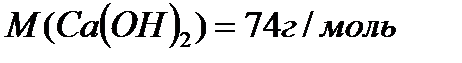
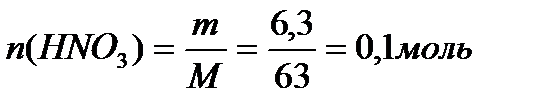
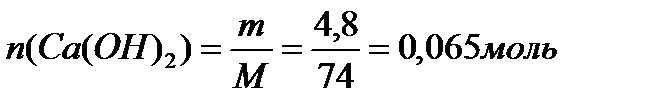
По уравнению 2 моль 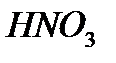 реагирует с 1 моль
реагирует с 1 моль 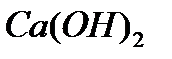
Значит 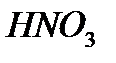 - в недостатке .
- в недостатке .
2 моль 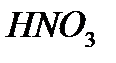 образует 1 моль
образует 1 моль 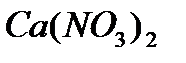
0,1 моль 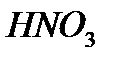 _________ 1 моль
_________ 1 моль 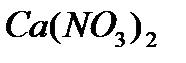
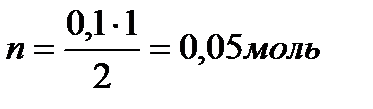

10) 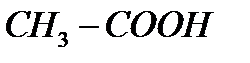 - уксусная кислота.
- уксусная кислота.
а)Диссоциация : 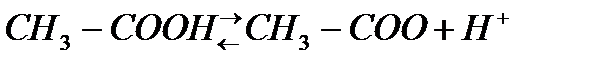
б)с металлами : 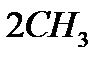
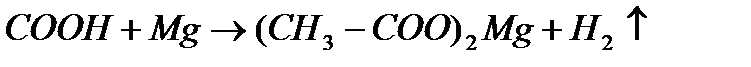
в)с оксидами металлов :
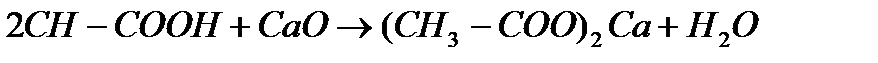
г)с основаниями :
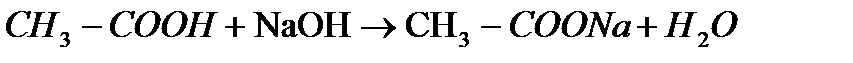
д) с солями :
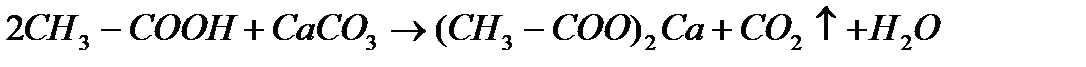
11) массовая доля растворенного вещества рассчитывают по формуле : 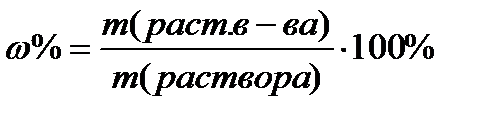
m(раствора)=350г+70г=420г
w%(соли)= 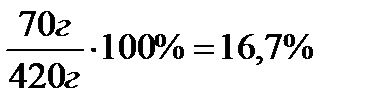
12) 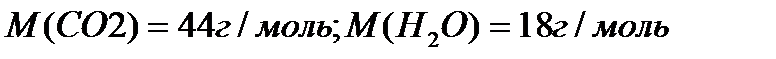
1)в 44г 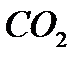 содержится 12г С
содержится 12г С 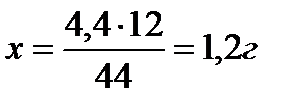
В 4,4г 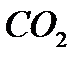 ___________
___________ 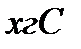
2)в 18г 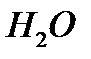 содержится 2г
содержится 2г 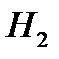
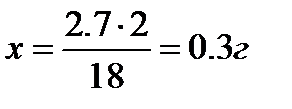
1,2+0,3=1,5 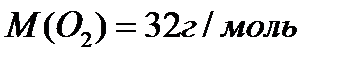
M(O)=2,3-1,5=0,8
3)Соотношения С:H:O= 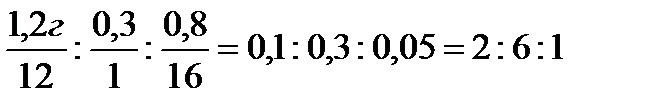
Ответ: 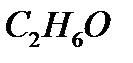
13) 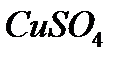 -сульфат меди
-сульфат меди
а) 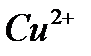 реакция на катион меди
реакция на катион меди 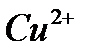
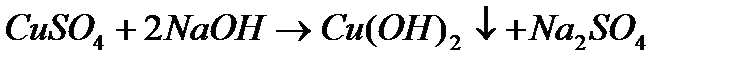
Выпадает голубой осадок
б) 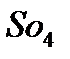 реакция на анион
реакция на анион 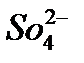
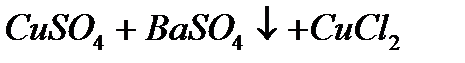
Выпадает белый осадок
14)Уравнение реакций :
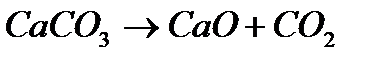
В 30 граммах 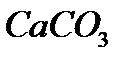 содержится 4% примесей , чистый карбонат кальция 96%
содержится 4% примесей , чистый карбонат кальция 96%
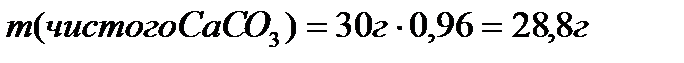
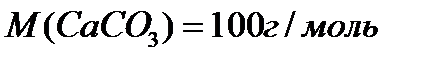
100г 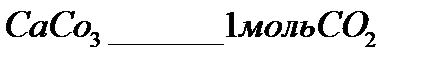
28,8г 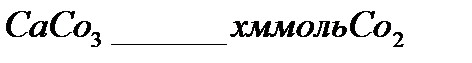
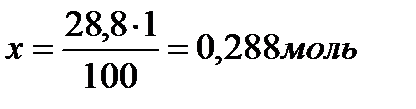
15)В пробирке, где находится серная кислота H2SO4 лакмус краснеет:
H2SO4 = 2H+ + SO42-
В пробирке , где находится гидроксид калия NaOH лакмус синеет:
NaOH = Na+ + OH-
А в пробирке с раствором хлорида натрия лакмус не изменяет цвет, так как в растворе Na Cl нет ионов H+ и OH-:
Na Cl = Na+ + Cl-
Таким образом, с помощью лакмуса можно распознать раствор кислоты, щелочи и соли
16)Уравнение реакции:
Zn + 2HCl = ZnCl2 + H2
Находим массу соляной кислоты в 60 г раствора:
m (HCl) = 60* 0,2 = 12г n (HCl) = 12/36,5 = 0,33 моль
2 моль HCl образует 1 моль соли (ZnCl2)
0,33 моль образует х моль ZnCl2
Х=n( ZnCl2) = 0,33 * 1/2 = 0,165 моль
Находим массу соли m (ZnCl2) = n( ZnCl2)*M( ZnCl2) = 0,165 * 136 = 22,44 г
17)Получение амфотерного гидроксида цинка Zn(OH)2:
ZnCl2 + 2NaOH = Zn( OH )2↓ + 2NaCl
Гидроксид цинка взаимодействует и с кислотами и с основаниями
а) с кислотами:
Zn( OH )2 + H2SO4 = ZnSO4 +2H2O
б) с щелочами:
Zn( OH )2 + NaOH =Na2⌠Zn(OH)4⌡-тетрагидроксоцинкат натрия
18) Уравнение реакции:
NH4Cl = NH3↑ = HCl
По уравнению, из 1 моль хлорида аммония NH4Cl образуется 1 моль аммиака. Находим количество вещества NH4Cl: M( NH4Cl) = 53,5 г/моль
n( NH4Cl) = m( NH4Cl) / M( NH4Cl) = 10,7/53,3 =0,2 моль
n( NH3) = n( NH4Cl) =0,2 моль
Находим объем аммиака: V( NH3) = n( NH3) * Vm =0,2 моль* 22,4 л/моль = 4,48 л
19) Реактивом на ионы Fe2+, Fe3+, Cu2+, Al3+ является раствор гидроксида натрия NaOH . Эти ионы при взаимодействии с ним образуют различного цвета осадки. При взаимодействии FeCl2 c NaOH выпадает зеленый осадок:
FeCl2+ 2NaOH = Fe(ОН)2↓ +2NaCl
FeCl3 дает бурый осадок:
FeCl3+3NaOH = Fe(ОН)3↓ +3NaCl
При взаимодействии CuCl2 c NaOH выпадает голубой осадок:
CuCl2+ 2NaOH = Cu(ОН)2↓ +2NaCl
При взаимодействии AlCl3 с NaOH выпадает белый творожистый осадок:
AlCl3+3NaOH = Al(ОН)3↓ +3NaCl
20) Уравнение реакции:
2Mg + O2 = 2MgO
Находим количество вещества магния : М (Mg) = 24 г/моль
n(Mg) =m(Mg) / М (Mg) = 40 г/24 г/моль =1,67 моль
При сгорании 1,67 моль Mg выделяется 212 КДж теплоты
2 моль(по уравнению)------х моль теплоты
Х = 2*212/1,67 =254 КДж
21) Превращение CuCl2→ Cu(ОН)2→ CuО
Уравнения реакций:
а) CuCl2+ 2NaOH = Cu(ОН)2↓ +2NaCl получение нерастворимого основания-гидроксида меди
б) Cu(ОН)2→ CuO + H2O получение оксида меди
22) Углекислый газ CO2 получают действием на мрамор(CaCO3) соляной кислотой(HCl).
CaCO3 +2HCl =CaCl2 + CO2↑ + H2O
Углекислый газ по газоотводной трубке пропускают через известковую воду ( раствор Ca(OH)2). При этом известковая вода мутнеет, выделяется белый осадок:
CO2+ Ca(OH)2 = CaCO3 + H2O эта реакция является качественной реакцией на углекислый газ
24) Металлы-магний- Mg, цинк -Zn и медь- Cu. Активность металлов определяем по электрохимическому ряду напряжений металлов. В ряду активности металлы расположены по возрастанию активности . Так как магний находится левее цинка и меди, то он является самым активным металлом среди них. А самым неактивным металлом является медь, не будет реагировать с раствором кислоты. Напишем уравнения реакций:
Mg + H2SO4 = Mg SO4+ H2
Zn + H2SO4 =Zn SO4+ H2
Cu + H2SO4 /= реакция не идет
25) MgàMgOàMg  à
à 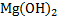 à
à 
а) 2Mg + O2 = 2MgO
б) MgO + 2HCl = MgCl2 + H2O
в) Mg 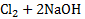 à
à 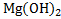 +2NaCl
+2NaCl
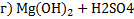 à
à  + H2O
+ H2O
Дата добавления: 2016-05-11; просмотров: 3586;
