Нарушения сердечного ритма и проводимости (с указанием формы). 3 страница
Критерии положительного дипиридамолового теста те же, что и при проведении пробы с дозированной физической нагрузкой: ишемическая депрессия или элевация сегмента RS–T на 1,0 мм и больше от исходного уровня. Введение дипиридамола может сопровождаться небольшой тахикардией, снижением АД, головной болью, тяжестью в нижних конечностях.
Чувствительность дипиридамолового теста составляет 60–75%, специфичность — 70–90%.
Проба с добутамином
Проба с добутамином является одной из самых информативных функциональных нагрузочных проб и в настоящее время широко используется в клинической практике. Добутамин обладает, как известно, выраженным бета-адреностимулирующим действием. При введении препарата увеличивается ЧСС, повышается АД, значительно увеличивается работа сердца и, соответственно, потребность миокарда в кислороде. В условиях лимитированного коронарного кровоснабжения это приводит к возникновению преходящей ишемии миокарда.
Добутамин вводят внутривенно в увеличивающихся дозах (5, 10, 15, 20, 30 мг на 1 кг массы тела в минуту) с интервалами в 3 мин. Введение препарата осуществляют с помощью автоматического инфузомата.
Для диагностики преходящей ишемии миокарда используют те же критерии, что и при проведении проб с дозированной физической нагрузкой и дипиридамолового теста. Чувствительность пробы с добутамином изопротеренолом составляет 60–70%, специфичность — 70–90%. Проба используется в основном для диагностики ИБС у больных, у которых выполнение интенсивной физической нагрузки по разным причинам невозможно.
Проба с эргометрином
Проба с эргометрином, являющимся стимулятором альфа-адренорецепторов, используется в основном для подтверждения спастического механизма коронарной недостаточности, в частности, у больных ИБС, у которых во время коронароангиографии не обнаруживается стенозирование КА, а клиническая картина заставляет заподозрить вазоспастическую форму стенокардии (стенокардия Принцметала). Проба с эргометрином опасна развитием тяжелых осложнений (ИМ, внезапная смерть, желудочковые аритмии), в связи с чем она используется для диагностики ИБС только в специализированных научно-исследовательских учреждениях (Д.М. Аронов, В.П. Лупанов, 2002).
Чреспищеводная электрическая стимуляция сердца
Чреспищеводная электрическая стимуляция сердца (ЧПЭС)—неинвазивный метод исследования, который используется для диагностики скрытой коронарной недостаточности у больных ИБС, изучения характера и электрофизиологических механизмов нарушений ритма сердца, а также для купирования пароксизмальных наджелудочковых тахиаритмий.
Сущность метода заключается в регулируемом увеличении числа сердечных сокращений (ЧСС) путем навязывания искусственного ритма электрической стимуляцией предсердий (подробнее — см. главу 3). Напомним, что для проведения ЧПЭС используется гибкий биполярный электрод-катетер, который вводится через нос или рот в пищевод на глубину примерно 45 см и устанавливается на уровне предсердий. Для возбуждения предсердий используют силу тока от 20 мА до 30 мА. При этом напряжение достигает 30–60 В.
Ниже приведена техника ЧПЭС, используемой для выявления скрытой коронарной недостаточности. Регулируемое увеличение ЧСС значительно повышает работу сердца и потребность миокарда в кислороде, что в условиях лимитированного коронарного кровотока у больных ИБС может приводить к развитию приступа стенокардии и/или появлению на поверхностной ЭКГ ишемических изменений.
После регистрации исходной ЭКГ в 12 отведениях начинают чреспищеводную электрическую стимуляцию сердца. По достижении стабильной ЧСС в 100 уд/мин, ступенеобразно (через каждые 1–2 минуты) увеличивают темп навязываемых сердечных сокращений на 15–20 уд/мин. При хорошей переносимости пробы и отсутствии ишемических изменений на ЭКГ достигают ЧСС 160 уд/мин, удерживая такой темп сердечных сокращений в течение 10 мин, после чего отключают электрокардиостимулятор, восстанавливая исходный синусовый ритм. Естественно, чреспищеводная электростимуляция сердца может быть прекращена “досрочно” при появлении клинических или/и электрокардиографических признаков возникновения ишемии миокарда. Пробу с ЧПЭС проводят под постоянным контролем ЭКГ на экране осциллоскопа, уровня АД и состояния пациента. ЭКГ регистрируют в конце каждой минуты исследования.
Оценку результатов исследования проводят по тем же принципам, что и при проведении теста с дозированной физической нагрузкой. Если при 10-минутном навязывании ритма с частотой 160 сокращений в минуту отсутствуют клинические и/или электрокардиографические признаки преходящей ишемии миокарда, проба считается отрицательной.
Следует подчеркнуть, что чувствительность метода чреспищеводной электростимуляции сердца для диагностики ИБС несколько ниже, чем теста с дозированной физической нагрузкой, поскольку степень увеличения потребности миокарда в кислороде при искусственном навязывании ритма сердечных сокращений существенно меньше, чем при выполнении физической нагрузки.
Применение метода ЧПЭС для диагностики ИБС показано в основном в тех случаях, когда проба с дозированной физической нагрузкой не может быть проведена в связи с заболеваниями опорно-двигательного аппарата, выраженной сердечной или дыхательной недостаточностью, наличием тромбофлебита или облитерирующего атеросклероза артерий нижних конечностей, а также у малотренированных больных, у которых невозможно достижение максимальной или субмаксимальной ЧСС при выполнении физической нагрузки. ЧПЭС противопоказана при заболеваниях пищевода, а также при наличии мерцательной аритмии, атриовентрикулярной блокады II–III степени, блокады левой ножки пучка Гиса и синдрома WPW.
Длительное мониторированиеЭКГ по Холтеру
В последние годы широкое распространение в клинической практике получило длительное мониторирование ЭКГ по Холтеру. Метод применяется в основном для диагностики преходящих нарушений ритма сердца, выявления ишемических изменений ЭКГ у больных ИБС, а также для оценки вариабельности сердечного ритма. Существенным преимуществом метода является возможность длительной (в течение 1–2 суток) регистрации ЭКГ в привычных для пациента условиях.
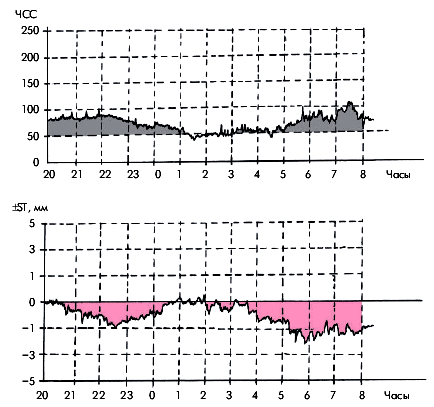
У большинства больных ИБС метод холтеровского мониторирования ЭКГ позволяет получить дополнительные объективные подтверждения временной преходящей ишемии миокарда в виде депрессии или/и элевации сегмента RS–T, часто сопровождающихся изменениями ЧСС и АД (рис. 5.28). Важно, что непрерывная запись ЭКГ проводится в условиях обычной для данного пациента активности. В большинстве случаев это дает возможность изучить взаимосвязь эпизодов ишемических изменений ЭКГ с разнообразными клиническими проявлениями болезни, в том числе и атипичными.
|
| Рис. 5.28. Суточные графики ЧСС (вверху) и смещения сегмента RS–T (внизу) |
Чувствительность и специфичность диагностики ИБС с помощью метода суточного мониторирования ЭКГ по Холтеру зависят прежде всего от выбранных критериев ишемических изменений конечной части желудочкового комплекса. Обычно используются те же объективные критерии преходящей ишемии миокарда, что и при проведении нагрузочных тестов, а именно: смещение сегмента RS–T ниже или выше изоэлектрической линии на 1,0 мм и более при условии сохранения этого смещения на протяжении 80 мс от точки соединения (j). Продолжительность диагностически значимого ишемического смещения сегмента RS–T при этом должна превышать 1 мин.
Сцинтиграфия миокарда с 201Тl
Сцинтиграфия миокарда—это метод визуализации сердечной мышцы, основанный на способности интактного или, наоборот, некротизированного миокарда накапливать некоторые радионуклидные соединения. В клинической практике наиболее широко применяют два метода сцинтиграфии миокарда: перфузионную сцинтиграфию с 201Тl и сцинтиграфию с 99mТс.
Исследование локальных нарушений перфузии миокарда.Сцинтиграфия миокарда с 201Тl (таллием) используется для выявления локальных нарушений коронарного кровотока у больных ИБС. Метод основан на способности интактного миокарда активно накапливать 201Тl. При нормальном коронарном кровоснабжении около 85–90% введенного внутривенно таллия захватывается миокардом. При нарушении коронарного кровотока у больных ИБС уровень экстракции этого вещества в бассейне стенозированной КА заметно снижается.
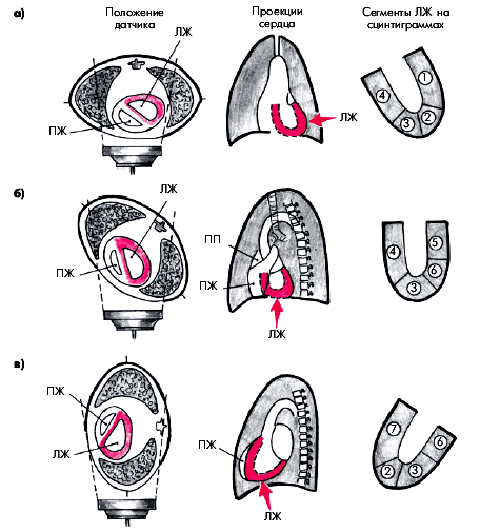
Исследования выполняют в специальном помещении, предназначенном для проведения радионуклидных исследований и оборудованном сцинтилляционной гамма-камерой, позволяющей получать изображение сердца в трех стандартных проекциях (рис. 5.29): передней прямой, левой передней косой (при повороте больного на 45°) и левой боковой (поворот на 90°). В каждой из этих проекций в течение 3–5 мин происходит накопление импульсов гамма-излучения, возникающего при распаде 201Тl, захваченного интактным миокардом. Чем лучше перфузия миокарда, тем более высокая степень радиоактивности регистрируется на экране компьютера. Наоборот, при локальном нарушении перфузии миокарда (ишемия, некроз, постинфарктный рубец) на сцинтиграммах выявляются “холодные очаги” снижения или отсутствия радиоактивности.
|
| Рис. 5.29. Стандартные проекции перфузионной сцинтиграфии с 201 Т1: а — передняя прямая проекция; б — левая передняя косая проекция; в — левая боковая проекция. Слева показано положение грудной клетки пациента по отношению к датчику, в центре — проекции сердца, справа — схематическое изображение сцинтиграмм миокарда с выделением нескольких сегментов: 1 — переднебокового, 2 — верхушечного, 3 — заднедиафрагмального (нижнего), 4 — перегородочного, 5 — бокового, 6 — заднебазального сегментов; 7 — проекция передней стенки ЛЖ |
Проведение исследования в трех проекциях позволяет детально изучить перфузию миокарда в нескольких сегментах ЛЖ: переднесептальном, переднебоковом, заднедиафрагмальном, верхушечном и др. и, соответственно, косвенно установить локализацию и степень нарушения кровотока в бассейне той или иной КА. Возможности метода в топической диагностике нарушений коронарного кровотока у больных ИБС существенно расширяются при регистрации сцинтиграмм на высоте пробы с дозированной физической нагрузкой или во время дипиридамолового теста.
Исследование жизнеспособности миокарда. Метод сцинтиграфии с 201Тl позволяет дифференцировать ишемизированную, но сохранившую жизнеспособность сердечную мышцу от рубцовой нежизнеспособной ткани. Вначале исследуют распределение радиофармпрепарата (РФП) на высоте нагрузочного теста. Появление “холодного очага” в одном из сегментов ЛЖ свидетельствует о сниженной перфузии, которая может быть обусловлена наличием здесь как преходящей ишемии миокарда, индуцированной нагрузочным тестом, так и рубцовой тканью. Поскольку ишемизированная мышца, сохранившая свою жизнеспособность, с течением времени все же медленно накапливает РФП, на отсроченных сцинтиграммах, зарегистрированных через 3–4 ч после введения таллия, дефект распределения препарата исчезает. В отличие от этого рубцовая ткань не может накапливать радиоактивный препарат, и на отсроченных сцинтиграммах дефект перфузии сохраняется.
В некоторых случаях, когда речь идет о существовании в ЛЖ участков гибернирующего (“спящего”) и/или оглушенного миокарда, при повторном исследовании через 3–4 ч после введения препарата дефект распределения может остаться. В этих случаях рекомендуется повторить исследование через 24 ч. Нормализация распределения таллия на таких поздних сцинтиграммах указывает на сохранившуюся жизнеспособность сердечной мышцы (гибернирующий или “оглушенный” миокард) (рис. 5.30). При наличии в сердечной мышце рубцовой ткани “холодный очаг” продолжает фиксироваться даже через 24 ч от начала исследования (рис. 5.31).
 Запомните
1. Выполнение сцинтиграфии миокарда с таллием наиболее показано у больных ИБС с атипичным болевым синдромом и неинформативной или малоинформативной ЭКГ при проведении функциональных нагрузочных тестов (отрицательная или сомнительная проба, наличие блокады ножек пучка Гиса, выраженной гипертрофии миокарда и т.п.). 2. Для оценки жизнеспособности миокарда в области “холодного очага” необходимо повторить исследования через 3–4 ч, а при необходимости — через 24 ч после введения препарата. Запомните
1. Выполнение сцинтиграфии миокарда с таллием наиболее показано у больных ИБС с атипичным болевым синдромом и неинформативной или малоинформативной ЭКГ при проведении функциональных нагрузочных тестов (отрицательная или сомнительная проба, наличие блокады ножек пучка Гиса, выраженной гипертрофии миокарда и т.п.). 2. Для оценки жизнеспособности миокарда в области “холодного очага” необходимо повторить исследования через 3–4 ч, а при необходимости — через 24 ч после введения препарата.
|

|
| Рис. 5.30. Схематическое изображение сцинтиграмм миокарда с 201 Т1, зарегистрированных у больного ИБС с выраженным очаговым нарушением перфузии переднеперегородочного и верхушечного сегментов ЛЖ на высоте дипиридамолового теста (а), через 3 ч (б) и через 24 ч после него. Сверху вниз: передняя прямая, левая передняя косая и левая боковая проекции. Во время нагрузочного теста выявляется отчетливое снижение радиоактивности в указанных сегментах (темные участки сцинтиграммы). Через 3 ч после исследования признаки нарушенной перфузии уменьшились, но не исчезли полностью(«гибернирующий» миокард). Через 24 ч после нагрузки — полное восстановление перфузии, что свидетельствует о жизнеспособности миокарда |

|
| Рис. 5.31. Схематическое изображение сцинтиграмм миокарда с 201 Т1, зарегистрированных у больного ИБС с выраженным очаговым нарушением перфузии заднедиафрагмального (нижнего) сегмента ЛЖ на высоте дипиридамолового теста (а), через 3 ч (б) и через 24 ч после него (в). Во время нагрузочного теста выявляется отчетливое снижение радиоактивности в нижнем сегменте (темный участок сцинтиграммы). Через 3 чи 24 чэтипризнаки полностью сохраняются, что свидетельствует о нежизнеспособности миокарда в этой зоне (рубец после перенесенного ИМ). |
Позитронная эмиссионная томография
Позитронная эмиссионная томография (ПЭТ) — относительно новый и высокоинформативный неинвазивный метод исследования метаболизма сердечной мышцы, поглощения кислорода и коронарной перфузии. Метод основан на регистрации лучевой активности сердца после введения специальных радиоактивных меток, которые включаются в те или иные обменные процессы (гликолиз, окислительное фосфорилирование глюкозы, β-окисление жирных кислот и т.д.), имитируя “поведение” основных метаболических субстратов (глюкозы, жирных кислот и т.п.).
У больных ИБС метод ПЭТ позволяет неинвазивным способом изучать региональный миокардиальный кровоток, метаболизм глюкозы и жирных кислот, поглощение кислорода. ПЭТ оказалась незамененимым методом в диагностике жизнеспособности миокарда. Так например, когда нарушение локальной сократимости ЛЖ (гипокинезия, акинезия) обусловлено гибернирующим или оглушенным миокардом, сохранившим свою жизнеспособность, при ПЭТ можно зарегистрировать метаболическую активность данного участка сердечной мышцы (рис. 5.32), тогда как при наличии рубца такая активность не выявляется.
| Рис. 5.32. Результаты позитронной эмиссионной томографии (ПЭТ) у больного ИБС до (а) и после (б) применения антиангинальных лекарственных средств. Наблюдается значительное увеличение окисления глюкозы в ишемизированном миокарде ЛЖ, сохранившем жизнеспособность | 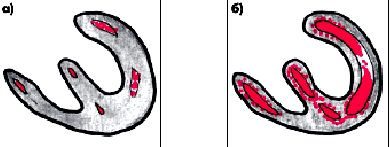
|
Эхокардиография
Эхокардиографическое исследование у больных ИБС позволяет получить важную информацию о морфологических и функциональных изменениях в сердце. С помощью эхокардиографии (ЭхоКГ) диагностируют:
- нарушения локальной сократимости ЛЖ, обусловленные снижением перфузии отдельных сегментов ЛЖ во время нагрузочных тестов (стресс-эхокардиография);
- жизнеспособность ишемизированного миокарда (диагностика “гибернирующего” и “оглушенного” миокарда);
- постинфарктный (крупноочаговый) кардиосклероз и аневризму ЛЖ (острую и хроническую);
- наличие внутрисердечного тромба;
- наличие систолической и диастолической дисфункции ЛЖ;
- признаки застоя в венах большого круга кровообращения и (косвенно) — величину ЦВД;
- признаки легочной артериальной гипертензии;
- компенсаторную гипертрофию миокарда желудочков;
- дисфункцию клапанного аппарата (пролабирование митрального клапана, отрыв хорд и папиллярных мышц, и др.);
- изменение некоторых морфометрических параметров (толщины стенок желудочков и размеров камер сердца);
- нарушение характера кровотока в крупных КА (некоторые современные методики ЭхоКГ).
Получение столь обширной информации возможно только при комплексном использовании трех основных режимов эхокардиографии: одномерного (М-режима), двухмерного (В-режима) и допплеровского режима.
Оценка систолической и диастолической функции левого желудочка
Систолическая функция ЛЖ. Основными гемодинамическими показателями, отражающими систолическую функцию ЛЖ, являются ФВ, УО, МО, СИ, а также конечно-систолический (КСО) и конечно-диастолический (КДО) объемы ЛЖ. Эти показатели получают при исследовании в двухмерном и допплеровском режимах по методике, подробно описанной в главе 2.
Как было показано выше, наиболее ранним маркером систолической дисфункции ЛЖ является уменьшение фракции выброса (ФВ) до 40–45% и ниже (табл. 2.8), которое обычно сочетается с увеличением КСО и КДО, т.е. с дилатацией ЛЖ и его объемной перегрузкой. При этом следует иметь в виду сильную зависимость ФВ от величины пред- и постнагрузки: ФВ может уменьшаться при гиповолемии (шок, острая кровопотеря и т.д.), уменьшении притока крови к правому сердцу, а также при быстром и резком подъеме АД.
В табл. 2.7 (глава 2) были представлены нормальные величины некоторых эхокардиографических показателей глобальной систолической функции ЛЖ. Напомним, что умеренно выраженная систолическая дисфункция ЛЖ сопровождается снижением ФВ до 40–45% и ниже, увеличением КСО и КДО (т.е. наличием умеренной дилатации ЛЖ) и сохранением в течение некоторого времени нормальных значений СИ (2,2–2,7 л/мин/м2). При выраженной систолической дисфункции ЛЖ происходит дальнейшее падение величины ФВ, еще большее увеличение КДО и КСО (выраженная миогенная дилатация ЛЖ) и уменьшение СИ до 2,2 л/мин/м2 и ниже.
Диастолическая функция ЛЖ. Диастолическую функцию ЛЖ оценивают по результатам исследования трансмитрального диастолического кровотока в импульсном допплеровском режиме (подробнее см. главу 2). Определяют: 1) максимальную скорость раннего пика диастолического наполнения (Vmax Peak Е); 2) максимальную скорость трансмитрального кровотока во время систолы левого предсердия (Vmax Peak А); 3) площадь под кривой (интеграл скорости) раннего диастолического наполнения (MV VTI Peak Е) и 4) площадь под кривой позднего диастолического наполнения (MV VTI Peak А); 5) отношение максимальных скоростей (или интегралов скорости) раннего и позднего наполнения (Е/А); 6) время изоволюмического расслабления ЛЖ — IVRT (измеряется при одновременной регистрации аортального и трансмитрального кровотока в постоянно-волновом режиме из апикального доступа); 7) время замедления раннего диастолического наполнения (DT).
Наиболее частыми причинами диастолической дисфункции ЛЖ у больных ИБС со стабильной стенокардией являются:
- атеросклеротический (диффузный) и постинфарктный кардиосклероз;
- хроническая ишемия миокарда, в том числе “гибернирующий” или “оглушенный” миокард ЛЖ;
- компенсаторная гипертрофия миокарда, особенно выраженная у больных с сопутствующей АГ.
В большинстве случаев наблюдаются признаки диастолической дисфункции ЛЖ по типу “замедленной релаксации”, для которой характерно снижение скорости раннего диастолического наполнения желудочка и перераспределение диастолического наполнения в пользу предсердного компонента. При этом значительная часть диастолического кровотока осуществляется во время активной систолы ЛП. На допплерограммах трансмитрального кровотока выявляется снижение амплитуды пика Е и увеличение высоты пика А (рис. 2.57). Отношение Е/А уменьшается до 1,0 и ниже. Одновременно определяется увеличение времени изоволюмического расслабления ЛЖ (IVRT) до 90–100 мс и более и времени замедления раннего диастолического наполнения (DТ) — до 220 мс и более.
Более выраженные изменения диастолической функции ЛЖ (“рестриктивный” тип) характеризуются значительным ускорением раннего диастолического наполнения желудочка (Peak Е) при одновременном уменьшении скорости кровотока во время систолы предсердия (Peak А). В результате отношение Е/А увеличивается до 1,6–1,8 и более. Эти изменения сопровождаются укорочением фазы изоволюмического расслабления (IVRT) до значений меньше 80 мс и времени замедления раннего диастолического наполнения (DT) — меньше 150 мс. Напомним, что “рестриктивный” тип диастолической дисфункции, как правило, наблюдается при застойной СН или непосредственно предшествует ей, свидетельствуя о повышении давления наполнения и КДД ЛЖ.
Оценка нарушений региональной сократимости левого желудочка
Выявление локальных нарушений сократимости ЛЖ с помощью двухмерной эхокардиографии имеет важное значение для диагностики ИБС. Исследование обычно проводится из верхушечного доступа по длинной оси в проекции двух- и четырехкамерного сердца, а также из левого парастернального доступа по длинной и короткой оси.
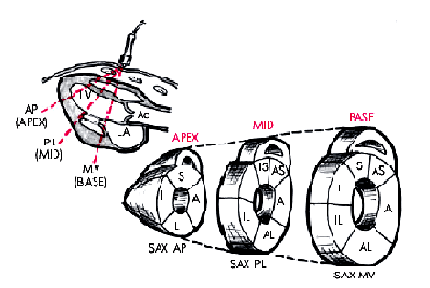
В соответствии с рекомендациями Американской ассоциации эхокардиографии ЛЖ при этом условно делится на 16 сегментов, располагающихся в плоскости трех поперечных сечений сердца, зарегистрированных из левого парастернального доступа по короткой оси (рис. 5.33). Изображение 6-ти базальных сегментов — переднего (А), переднеперегородочного (AS), заднеперегородочного (IS), заднего (I), заднебокового (IL) и переднебокового (AL) — получают при локации на уровне створок митрального клапана (SAX MV), а средних частей тех же 6-ти сегментов — на уровне папиллярных мышц (SAX PL). Изображения 4-х верхушечных сегментов — переднего (А), перегородочного (S), заднего (I) и бокового (L), — получают при локации из парастернального доступа на уровне верхушки сердца (SAX AP).
|
| Рис. 5.33. Деление миокарда левого желудочка на сегменты (парастернальный доступ по короткой оси). Показаны 16 сегментов, располагающихся в плоскости трех поперечных сечений ЛЖ на уровне створок митрального клапана (SАХ МV), папиллярных мышц (SАХ РL) и верхушки (SАХ АР). BASE — базальные сегменты, МID — средние сегменты, АРЕХ — верхушечные сегменты; А — передний, АS — передне- перегородочный, IS — заднеперегородочный, I — задний, IL — заднебоковой, AL — переднебоковой, L– боковой и S —перегородочный сегменты |
Общее представление о локальной сократимости этих сегментов хорошо дополняют три продольных “среза” ЛЖ, зарегистрированных из парастернального доступа по длинной оси сердца (рис. 5.34), а также в верхушечной позиции четырехкамерного и двухкамерного сердца (рис. 5.35).
| Рис. 5.34. Деление миокарда левого желудочка на сегменты(парастернальный доступ по длинной оси). Обозначения те же | 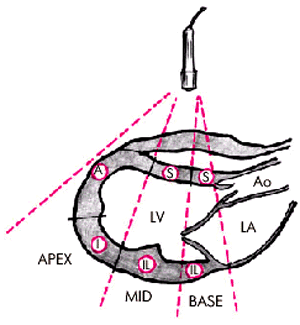
|
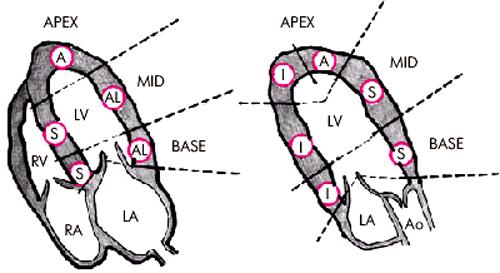
|
| Рис. 5.35. Деление миокарда левого желудочка на сегменты (апикальный доступ в позиции четырехкамерного и двухкамерного сердца). Обозначения те же |
В каждом из этих сегментов оценивается характер и амплитуда движения миокарда, а также степень его систолического утолщения. Различают 3 вида локальных нарушений сократительной функции ЛЖ, объединяемых понятем “асинергия” (рис. 5.36):
1. Акинезия — отсутствие сокращения ограниченной области сердечной мышцы.
2. Гипокинезия — выраженное локальное уменьшение степени сокращения.
3.Дискинезия — парадоксальное расширение (выбухание) ограниченного участка сердечной мышцы во время систолы.
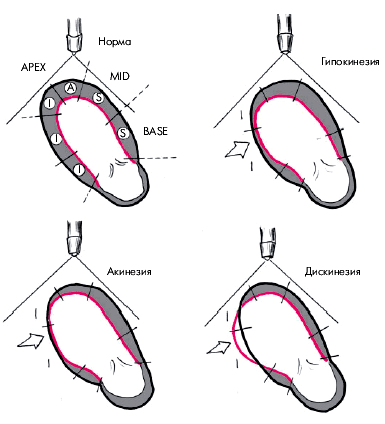
|
| Рис. 5.36. Различные виды локальной асинергии левого желудочка (схема). Черным цветом обозначен контур желудочка во время диастолы, красным — во время систолы |
Причинами локальных нарушений сократимости миокарда ЛЖ у больных ИБС являются:
- острый инфаркт миокарда (ИМ);
- постинфарктный кардиосклероз;
- преходящая болевая и безболевая ишемия миокарда, в том числе ишемия, индуцированная функциональными нагрузочными тестами;
- постоянно действующая ишемия миокарда, еще сохранившего свою жизнеспособность (“гибернирующий миокард”).
Следует также помнить, что локальные нарушения сократимости ЛЖ могут быть обнаружены не только при ИБС. Причинами таких нарушений могут быть:
- дилатационная и гипертрофическая кардиомиопатии, которые нередко также сопровождаются неравномерным поражением миокарда ЛЖ;
- локальные нарушения внутрижелудочковой проводимости (блокады ножек и ветвей пучка Гиса, синдром WPW и др.) любого генеза;
- заболевания, характеризующиеся объемной перегрузкой ПЖ (за счет парадоксальных движений МЖП).
Наиболее выраженные нарушения локальной сократимости миокарда выявляют при остром ИМ и аневризме ЛЖ. Примеры этих нарушений приведены в главе 6. У больных со стабильной стенокардией напряжения, перенесших в прошлом ИМ, можно выявить эхокардиографические признаки крупноочагового или (реже) мелкоочагового постинфарктного кардиосклероза.
Так, при крупноочаговом и трансмуральном постинфарктном кардиосклерозе двухмерная и даже одномерная ЭхоКГ, как правило, позволяет выявить локальные зоны гипокинезии или акинезии (рис. 5.37, а, б). Мелкоочаговый кардиосклероз или преходящая ишемия миокарда характеризуются появлением зон гипокинезии ЛЖ, которые чаще выявляются при переднеперегородочной локализации ишемического повреждения и реже — при его задней локализации. Нередко признаки мелкоочагового (интрамурального) постинфарктного кардиосклероза при эхокардиографическом исследовании не обнаруживаются.
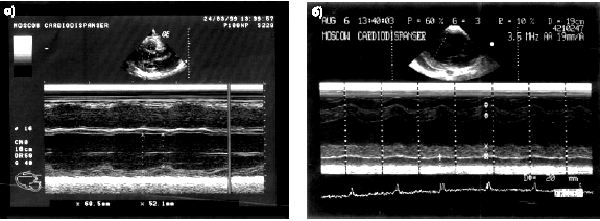
|
| Рис. 5.37. Эхокардиограммы больных с постинфарктным кардиосклерозом и нарушением региональной функции левого желудочка: а — акинезия МЖП и признаки дилатации ЛЖ (одномерная ЭхоКГ); б — акинезия заднего (нижнего) сегмента ЛЖ (одномерная ЭхоКГ) |
 Запомните
При достаточно хорошей визуализации сердца нормальная локальная сократимость ЛЖ у больных ИБС в большинстве случаев позволяет исключить диагноз трансмурального, или крупноочагового постинфарктного рубца и аневризмы ЛЖ, но не является основанием для исключения мелкоочагового (интрамурального) кардиосклероза. Запомните
При достаточно хорошей визуализации сердца нормальная локальная сократимость ЛЖ у больных ИБС в большинстве случаев позволяет исключить диагноз трансмурального, или крупноочагового постинфарктного рубца и аневризмы ЛЖ, но не является основанием для исключения мелкоочагового (интрамурального) кардиосклероза.
|
Нарушения локальной сократимости отдельных сегментов ЛЖ у больных ИБС принято описывать по пятибалльной шкале:
1 балл — нормальная сократимость;
2 балла — умеренная гипокинезия (незначительное снижение амплитуды систолического движения и утолщения в исследуемой области);
3 балла — выраженная гипокинезия;
4 балла — акинезия (отсутствие движения и утолщения миокарда);
5 баллов — дискинезия (систолическое движение миокарда исследуемого сегмента происходит в направлении, противоположном нормальному).
Для такой оценки, помимо традиционного визуального контроля, используется покадровый просмотр изображений, записанных на видеомагнитофоне.
Важное прогностическое значение имеет расчет так называемого индекса локальной сократимости (ИЛС), который представляет собой сумму балльной оценки сократимости каждого сегмента (SS), деленную на общее число исследованных сегментов ЛЖ (n):
ИЛС = ΣS / n .
Высокие значения этого показателя у больных ИМ или постинфарктным кардиосклерозом нередко ассоциируются с повышенным риском летального исхода.
Следует помнить, что при эхокардиографическом исследовании далеко не всегда удается добиться достаточно хорошей визуализации всех 16 сегментов. В этих случаях учитывают только те участки миокарда ЛЖ, которые хорошо выявляются при двухмерной эхокардиографии. Нередко в клинической практике ограничиваются оценкой локальной сократимости 6 сегментов ЛЖ: 1) межжелудочковой перегородки (верхней и нижней ее части); 2) верхушки; 3) переднебазального сегмента; 4) бокового сегмента; 5) заднедиафрагмального (нижнего) сегмента; 6) заднебазального сегмента.
Дата добавления: 2016-04-22; просмотров: 898;
