Внутренняя энергия, работа и теплота в термодинамике.
Определение: внутренняя энергия термодинамической системы называется энергия, включающая в себя энергию всевозможных видов движения и взаимодействия всех частиц (молекул, атомов...) образующих ТДС.
Внутренняя энергия системы , находящихся в газообразном состоянии:
1) Кинетическая энергия беспорядочно движущихся (поступательное и вращательное) молекул, также колебательные движения атомов в молекуле.
2) Потенциальная энергия обуславливается силами межмолекулярного взаимодействия.
3) Энергия электронов оболочек атомов.
4)  Энергия движения и взаимодействие нуклонов в атомных ядрах.
Энергия движения и взаимодействие нуклонов в атомных ядрах.
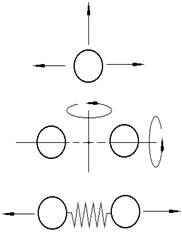
ί=3 одноатомная молекула
x,y,z,θ,φ
ί=5 двухатомная молекула
(поступательное+ вращательное+
колебательное)
Независимо от числа степеней свободы молекул, 3 степени свободы- поступают и на каждую из этих степеней свободы приходится средняя кинетическая энергия 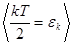 . В классической статистической физике выводится закон Больцмана о равномерном распределении энергии по степеням свободы молекул. Для статистической системы, находящейся в состоянии термодинамического равновесия на каждую поступательную и вращательную степени свободы молекул приходится энергия
. В классической статистической физике выводится закон Больцмана о равномерном распределении энергии по степеням свободы молекул. Для статистической системы, находящейся в состоянии термодинамического равновесия на каждую поступательную и вращательную степени свободы молекул приходится энергия 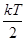 , а на каждую колебательную степень свободы приходится кинетическая энергия, равная
, а на каждую колебательную степень свободы приходится кинетическая энергия, равная 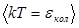 .
.
Внутренняя энергия выражается:

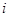 - степень свободы для 1 моля
- степень свободы для 1 моля
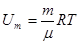 для газа массы m.
для газа массы m.
Определение: энергия, передаваемая рассматриваемой термодинамической системы внешними телами называется работой, совершаемой над системой. Энергия, передаваемая системе внешними телами путём теплообмена называется тепловой.
Работа и теплота, в отличие от внутренней энергии характеризует не состоянием системы, а процессы происходящие внутри системы, следовательно, работа и теплота не являются функциями состояния, а величины 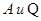 ,
, 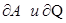 не являются полными дифференциалами.
не являются полными дифференциалами.
1.4 Первое начало термодинамики.
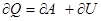

Теплота, сообщаемая системе, расходуется на изменение её внутренней энергии и на совершение работы системой над внешними телами. 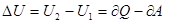
Если система периодически возвращается в первоначальное состояние, то изменение внутренней энергии равно нулю. A=Q.
Вечный двигатель первого рода - периодически действующий двигатель, который совершал бы большую работу, чем сообщает ему из вне энергию невозможен.
1.5 Работа расширения газа.
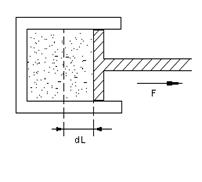 |
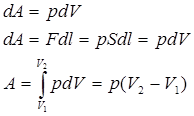
1.6 Теплоёмкость вещества.
Удельная теплоёмкость вещества – величина, равная количеству теплоты, которой необходимо для нагревания 1кг вещества на 1к.
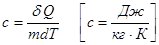
Молярная теплоёмкость – величена численно равная количеству теплоты для поднятия температуры 1моля вещества на 1к.

Первое начало термодинамики, записанное для 1моля газа имеет вид:

Если газ нагревают при постоянном объеме, то работа dA=Q и теплота идёт только на изменение внутренней энергии:
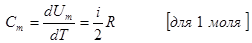
Если газ нагревают при постоянном давлении,то:
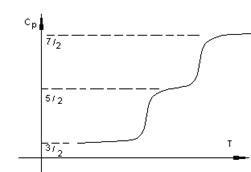
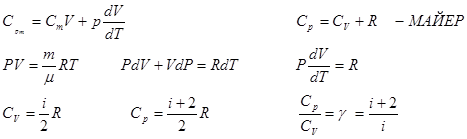
1.7 Применение первого начала термодинамики к изопроцессам.
1) V=const, m=const изохорный процесс
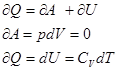
для 1 моля 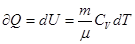
2) Изобарный процесс р=const, m=const
dA=pdV
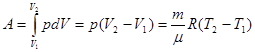
Из полученного соотношения следует физический смысл универсальная газовая постоянная R, т.е. если разность температур  , равна 1 К, то для 1 моля газа R равна работе А при изобарном процессе
, равна 1 К, то для 1 моля газа R равна работе А при изобарном процессе 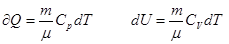
3) Изотермичесский процесс
T=const, m=const
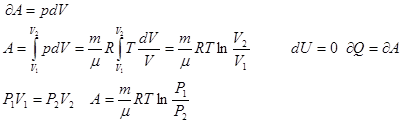
1.8 Адиабатный процесс.
- процесс, при котором отсутствует теплообмен между системой и окружающей средой 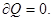
| <== предыдущая лекция | | | следующая лекция ==> |
| Місцеві податки і збори | | | Производная давления. |
Дата добавления: 2016-04-19; просмотров: 939;
