Иммунопрофилактика вич-инфекции
В течение длительного времени предпринимаются попытки разработать вакцину против ВИЧ, однако до сих пор надёжной и безопасной вакцины против ВИЧ не существует.
Разработка эффективных вакцин от вич-инфекции сложна из-за отсутствия адекватных животных моделей и невозможности оценить их эффективность у человека. К испытаниям предложены аттенуированные живые вакцины из рекомбинантных штаммов, лишённых инфекционности, убитые вакцины, рекомби-нантные вирусные вакцины и субъединичные вакцины.
Общие методы профилактики вич-инфекции включают выявление ВИЧ-инфицированных и больных со СПИДом среди групп риска, контроль препаратов крови, более широкое внедрение разового медицинского инструментария, использование персоналом ЛПУ индивидуальных средств защиты (перчатки, пластиковые забрала и др.), проведение просветительской работы по профилактике инфекций, передающихся половым путём.
| Вирус герпеса открывает путь к дешевому лекарству от СПИДа |
15.09.08 | Медицина, Молекулярная биология, Микробиология, Алексей Левин | Комментарии (2)
|
В одной из лабораторий американского Национального института детского здоровья и развития человека (NICHD) в Бетесде выполнена работа, которая может открыть новые перспективы в борьбе со СПИДом. Скажу сразу — она не обещает излечения в смысле полного выведения вируса из организма; более того, есть основания считать, что эта задача сегодня практически неразрешима и останется таковой в обозримой перспективе. Однако вполне возможно, что результаты ученых из Соединенных Штатов, Великобритании, Канады и Бельгии, полученные под руководством вирусолога Леонида Марголиса, обернутся появлением новых методик медикаментозного снижения уровня вирусной нагрузки (то есть концентрации вирионов в плазме крови). Эти результаты представлены в статье, которая 11 сентября появилась в журнале Cell Host & Microbe.
Результаты, о которых идет речь, были получены не то что бы чисто случайно, но всё же благодаря немалому везению (впрочем, то же самое можно сказать о великом множестве других научных открытий). В отделе межклеточных взаимодействий NICHD, который возглавляет Марголис, уже давно изучают последствия совместного инфицирования различных тканей вирусом человеческого иммунодефицита и другими патогенными микробами. Подобные исследования (а они ведутся во многих лабораториях) очень важны как для науки, так и для практической медицины.
Давно известно, что наличие вируса иммунодефицита человека (ВИЧ) не только осложняет течение инфекционных заболеваний, но также увеличивает риск возникновения патологий, вызываемых относительно безвредными микроорганизмами. Чаще всего это происходит благодаря общеизвестному подавлению активности иммунной системы этим вирусом. Однако случается, что ВИЧ отягощает течение других заболеваний и в тех случаях, когда он еще не успевает приступить к уничтожению иммунных Т-клеток (речь, конечно, идет о CD4+-лимфоцитах, которые являются главным объектом его атаки). С другой стороны, некоторые микробы способны частично подавлять репликацию ВИЧ и тем самым замедлять прогресс СПИДа. Отсюда следует, что ВИЧ в состоянии непосредственно взаимодействовать с другими инфекционными агентами в тех тканях и органах, где он с ними сосуществует. Есть все основания считать, что такие взаимодействия могут приводить к весьма нетривиальным эффектам.
Леонид Марголис и его коллеги занимались, в частности, контактами между ВИЧ и различными разновидностями герпес-вирусов (точнее, вирусов человеческого герпеса, HHV). Их не так уж и мало, в общей сложности восемь. Помимо общеизвестных вирусов простого герпеса первого и второго типов (Herpes simplex virus), которые приводят к появлению сыпи на коже или слизистых оболочках, в эту группу входят вирус Эпштейна–Барра (Epstein–Barr Virus), цитомегаловирус (Cytomegalovirus), вирус ветряной оспы (Varicella zoster virus), а также еще тройка герпес-вирусов, занумерованных цифрами 6, 7 и 8. HHV-8 провоцирует саркому Капоши и еще некоторые злокачественные опухоли, в то время как HHV-6 и HHV-7 чаще всего либо не дают никаких симптомов, либо вызывают у маленьких детей малоопасные кожные раздражения, которые обычно исчезают без лекарственного лечения. По данным медицинской статистики, не менее 95% людей в детстве заражаются этими вирусами, которые продолжают потихоньку размножаться в организме под контролем иммунной системы.
Марголис и его сотрудники сначала изучали сосуществование ВИЧ и вируса простого герпеса второго типа (HHV-2) в культурированных кусочках человеческой лимфоидной ткани, а также ткани шейки матки и ректосигмоидного отдела ободочной кишки (поскольку эти ткани служат входными воротами для ВИЧ). В ходе этих экспериментов они использовали вещества, блокирующие размножение того или иного вируса. Для подавления герпес-вируса они использовали ацикловир (Acyclovir), один из синтетических препаратов, созданных в лаборатории лауреата Нобелевской премии 1988 года Гертруды Элайон (Gertrude B. Elion).
Это лекарство (торговое название зовиракс) вот уже четверть века применяется в клинической практике и прекрасно работает как против обеих разновидностей вируса простого герпеса, так и против вируса ветряной оспы (эта тройка образует альфа-тип вируса герпеса). Ацикловир также замедляет размножение остальных вирусов герпеса (типы бета и гамма), хотя и с меньшей эффективностью. Экспериментаторы ожидали, что он просто выведет из игры HHV-2, но никак не повлияет на динамику ВИЧ. Однако тут-то их и подстерегала неожиданность. В образцах ткани, на которые воздействовали ацикловиром, резко снизилась концентрация обоих вирусов — как герпес-вируса, так и ВИЧ. В этом и состояло первичное открытие.
Сей результат поставил исследователей в тупик. Ацикловир ведь не раз проверяли на ВИЧ-инфицированных культурах СD4+-лимфоцитов, однако он никак не влиял на размножение вируса. Столкнувшись с этой загадкой, экспериментаторы взяли новые ткани тех же типов, теперь уже по отдельности заразили их обоими вирусами и тогда уже ввели ацикловир. Пролиферация вируса герпеса, как и ожидалось, сразу застопорилась, но то же самое случилось и с вирусом иммунодефицита. Так что ситуация стала еще непонятней. Эти опыты были повторены на клеточных культурах лимфоцитов-хелперов. Там уже всё было по учебнику: ацикловир действовал только против герпеса.
После этого стало очевидно, что парадоксальное воздействие ацикловира на ВИЧ как-то связано со средой его обитания. Уяснив это, экспериментаторы решили поискать следы вирусов герпеса в тех тканях, с которыми они раньше работали. Эти ткани, взятые от 38 доноров, были послеоперационными «обрезками», полученными из хирургических клиник. Естественно, это были ткани, свободные от вируса простого герпеса. Оказалось, однако, что все доноры, кроме одного, были в детстве инфицированы HHV-6 и другими видами герпес-вируса. А вот чистые лабораторные культуры T-лимфоцитов, на которых ставили контрольные эксперименты, никаких вирусов, конечно, не содержали. Отсюда следовал вывод, что ацикловир блокирует вирус СПИДа при каком-то участии вируса герпеса.
Со временем этот парадокс удалось разрешить. Как оказалось, он непосредственно связан с биохимическим механизмом воздействия ацикловира на герпес-вирус, который еще в начале 80-х годов независимо друг от друга установили Гертруда Элайон и Генри Балфур (Henry H. Balfour). Дело в том, что ацикловир в чистом виде практически никак не влияет на поведение герпес-вируса. Такое воздействие оказывает его трифосфат, то есть ацикловир, к молекуле которого подцеплены три фосфатные группы PO3H2. Трижды фосфорилированный ацикловир встраивается в вирусную ДНК (точнее, его туда вставляет вирусная полимераза) и останавливает ее дальнейший синтез. Этим и объясняется его воздействие на герпес.
|
В живых клетках процессы фосфорилирования катализируются ферментами из семейства киназ (они же фосфотрансферазы). Правда, те киназы, которые присутствуют в клетках, атакуемых герпес-вирусом, фосфорилируют ацикловир чрезвычайно медленно. Но и сам вирус производит фермент этого же типа — тимидин-киназу. Этот белок присоединяет фосфатную группу к молекуле ацикловира примерно в 3000 раз быстрее, чем клеточные киназы. Так возникает монофосфат ацикловира, который клеточные киназы уже без труда достраивают сначала до дифосфата, а потом и до трифосфата. Так что герпес-вирус фосфорилирует ацикловир себе же на погибель. Стоит отметить, что нефосфорилированный ацикловир практически никак не влияет на внутриклеточные процессы. Поэтому его можно принимать в огромных дозах, не опасаясь побочных эффектов — ведь он действует только на клетки, инфицированные герпесом.
Учет этого обстоятельства оказался ключом к разгадке. Поскольку вирус герпеса инициирует тройное фосфорилирование молекул ацикловира, было естественно предположить, что такие модифицированные молекулы обладают антиспидовым потенциалом. Эта гипотеза оправдалась Оказалось, что трифосфат ацикловира вмешивается в работу фермента, который позволяет вирусу СПИДа копировать свою генетическую информацию в атакованной клетке. В самом вирусе информация записана на молекулах рибонуклеиновых кислот, но, чтобы встроиться в клеточные ядра, вирус должен ее переписать на молекулы ДНК. Такую задачу выполняет обратная транскриптаза, которую и блокирует модифицированный ацикловир. Эта гипотеза была доказана прямыми экспериментами, выполненными соавторами Марголиса — профессором Университета Эмори Раймондом Шинази (Raymond F. Schinazi) и канадским молекулярным биологом Маттиасом Гётте (Matthias Götte).
Подведем итоги. Леонид Марголис и его коллеги экспериментально доказали, что трифосфат ацикловира по своему действию аналогичен противоспидовым препаратам из группы ингибиторов обратной транскриптазы. Это означает, что он может помочь в лечении тех ВИЧ-инфицированных пациентов, которые уже претерпели столкновение с герпес-вирусом — а таких, напомню, абсолютное большинство. Правда, еще предстоит установить, какая степень заражения теми или иными видами герпеса нужна для эффективного запуска фосфорилирования ацикловира и какие его дозы нужны для подавления репликации ВИЧ. На этот вопрос ответят только клинические испытания, которые уже ведутся. Стоит подчеркнуть, что ацикловир стал бы очень дешевым противоспидовым лекарством, ибо он по давности лет уже не защищен патентами.
Но есть и другая возможность. Как я уже отметил, монофосфат ацикловира прекрасно фосфорилируют и клеточные киназы. Для его получения, в принципе, не обязательно обращаться к помощи герпес-вируса. Команда Марголиса синтезировала это вещество и доказала, что оно подавляет размножение ВИЧ в клеточных культурах. Поэтому не исключено, что монофосфат ацикловира окажется самостоятельным антиспидовым лекарством. Однако это вещество, в отличие от собственно ацикловира, клинически не апробировано. Так что для демонстрации его безопасности и проверки терапевтического потенциала потребуются серьезные лабораторные тесты и клинические испытания, которые даже при самом благоприятном исходе растянутся на несколько лет.
Источник: Andrea Lisco, Leonid Margolis et al. Acyclovir Is Activated into a HIV-1 Reverse Transcriptase Inhibitor in Herpesvirus-Infected Human Tissues // Cell Host & Microbe. 11 September 2008. V. 4. P. 260–270; doi:10.1016/j.chom.2008.07.008.
| Употребляя термин "СПИД", не все знают, что это не самостоятельное заболевание, а терминальная (последняя) стадия ВИЧ-инфекции - инфекции, вызванной Вирусом Иммунодефицита Человека |
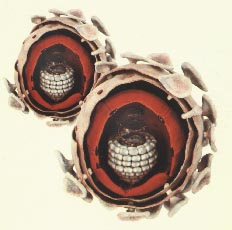
| ВИЧ принадлежит к семейству Retriviridae, подсемейству Lentivirus. Этот ретровирус, используя фермент обратную транскриптазу, трансформирует свой РНК-геном в ДНК, которую встраивает в гены клетки-хозяина. По сути, хозяином теперь становится ВИЧ, потому что новые клетки, получаемые в результате деления заражённой, уже несут в себе вирусные гены. Оправдывая своё название (Lentivirus - "медленный" вирус), ВИЧ никуда не спешит. |
Заражение происходит различными путями (см. таблицу - по Р.М. Хаитову)
| Пути передачи | Вероятность заражения при однократной воздействии, % | Вклад в распространение эпидемии, % |
| Сексуальные контакты (вагинальные, анальные, оральные) | 0,1 - 1,0 | 70 - 80 |
| Переливание крови и препаратов из неё | > 90 | 3 - 5 |
| Парентерально (загрязнённые медицинские и др. инструменты) | 0,5 - 1,0 | 5 - 10 |
| Ранения медперсонала загрязнёнными инструментами | < 0,5 | < 0,01 |
| Перинатальное (беременность, роды) инфицирование | 5 - 10 |
Из таблицы видно, что вероятность заражения при половом акте не "стопроцентна". Этому есть объяснение: инфицирование происходит при повреждениях слизистой оболочки половых органов, когда вирус попадает в кровь партнёра (поэтому наиболее опасны травматичные анальные контакты и случаи изнасилования). Кроме того, существенную роль играет иммунная система. Например, показано, что наличие делеции в гене CKR-5 (CСR-5) защищает от заражения вирусом иммунодефицита человека, причём устойчивость к ВИЧ-инфицированию передаётся по наследству. Тем не менее, массивное поступление ВИЧ в организм при переливании крови никакая иммунная система сдержать не в силах: вероятность заражения при гемотрансфузиях превышает 90%.
Тем не менее, некоторые данные, приведённые в таблице, уже неактуальны. Волна наркомании, захлестнувшая страну, привела к тому, что подавляющая часть ВИЧ-инфицированных - потребители наркотиков, инфицированные при внутривенном введении зелья общим грязным шприцем и т.п.
Инкубационный период (время до появления симптомов болезни) длится от нескольких месяцев до 8 - 10 лет (у 2/3 инфицированных лиц на протяжении 5 лет не было никаких симптомов СПИДа). Раньше ВИЧ-инфекция проявляет себя, будучи переданной при переливании крови, а также - при ослабленном иммунитете хозяина (наркомания и гомосексуализм не только увеличивают риск заражения, но и являются факторами подавления иммунитета).
| ВИЧ разрушает Т4-лимфоциты ("хелперы" - помощники клеточного иммунитета), а также уничтожает макрофаги. Как следствие нарушается иммунологический баланс - возрастает активность Т -лимфоцитов "супрессоров", подавляющих клеточный иммунитет. Развивается иммунологическая недостаточность - организм оказывается не в состоянии бороться с простейшими инфекциями, не говоря уже о грозных. | 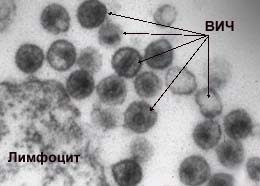
|
"В рост" идут дремлющие в организме многих из нас инфекции - герпетическая, цитомегаловирусная, грибковые - кандидоз, криптококкоз, прогрессирует туберкулёз, паразитарные заболевания - токсоплазмоз, амебиаз, пневмоцистная пневмония. Снижение клеточного иммунитета ведёт к возникновению опухолей, прежде всего - саркомы Капоши.
Следует отметить, что верными помощниками ВИЧ-инфекции являются практически все возбудители ИППП, присутствующие в нашей галерее, с другой стороны, ВИЧ создаёт благоприятнейшие условия для заражения этими инфекциями.
| Существует два типа ВИЧ: ВИЧ-1 и ВИЧ-2. Вторым заражаются реже, он имеет больший инкубационный период. Тем не менее обольщаться относительно "безопасности" ВИЧ-2 не стоит. |
| Вирус ВИЧ находится в крови, сперме, вагинальном секрете. Поэтому заражение возможно там и тогда, где и когда эти биологические жидкости могут попасть в кровь другого человека. Так, в России в настоящее время заражение чаще всего происходит в среде употребляющих наркотики при повторном использовании загрязнённого кровью шприца. | 
|
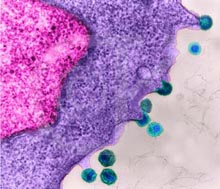
|  Вирусы иммунодефицита (HIV) присоединяются к гликопротеиновым рецепторам на поверхности лимфоцита. СЭМ х 110.620. Условные цвета. Вирусы иммунодефицита (HIV) присоединяются к гликопротеиновым рецепторам на поверхности лимфоцита. СЭМ х 110.620. Условные цвета.
|
Первые симптомы ВИЧ- инфекции неспецифичны: "немотивированное" повышение температуры тела, слабость, потливость, повышенная утомляемость, головная боль, кашель, расстройство стула, похудание, увеличение печени, селезёнки и лимфоузлов. Дальнейшие проявления зависят от сочетания многочисленных и разнообразных инфекций, развивающихся на фоне СПИДа.
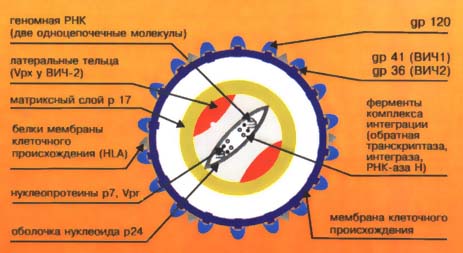
Строение ВИЧ, антигенный состав*
* этот материал может оказаться весьма полезным, а иногда и необходимым при выяснении преимуществ и недостатков различных методов диагностики ВИЧ. Кроме того, он незаменим при самостоятельной "расшифровке" результатов анализов
|
На поверхности ВИЧ присутствуют многочисленные выступы, состоящие из белково-полисахаридных комплексов - гликопротеинов. Именно от них зависит способность вируса присоединяться к Т4 рецепторам на поверхности лимфоцитов, проникать в них и разносится с лимфоцитами по всему организму.
В конусовидной сердцевине вируса находятся тяжи РНК - геном вируса. Основными структурными генамиВИЧ, кодирующими трансляцию белков, из которых в последующем строится вирус, являются gag (group — specificantigens), pol (polymerase), env (envelope).
К регуляторным генамотносятся: tat (трансактиватор всех вирусных белков), rev (регулятор экспрессии вирионных белков), vif (вирионный инфекционный фактор), vpr (функции остаются неясными), nef (негативный фактор экспрессии), vpx (функции неизвестны). Ген gag кодирует белки сердцевины. Первичным продуктом трансляции этого гена является белок-предшественник р53, подвергающийся расщеплению двумя путями. При одном варианте расщепления из белка-предшественника образуется 3 структурных белка сердцевины: р15, р17, р24. Другой вариант предполагает образование промежуточного белка р39, который расщепляется на белки р17 и р24. В сыворотке крови большинства инфицированных ВИЧ выявляются антитела к этим антигенам. Обычно антитела к р24 обнаруживаются на ранней стадии ВИЧ-инфекции, причем белок р24 является более иммуногенным, чем р17. Ген pol кодирует белки р51/66 и р31, которые представляют собой обратную транскриптазу и эндонуклеазу ВИЧ.
Наиболее иммуногенными белками вирусной частицы, как и других известных форм вирусных инфекций, являются поверхностные гликопротеины gp 160/120, а также трансмембранный белок gp 41, которые кодируются геном env. Антитела к белкам, кодируемым геном env, появляются относительно рано, выявляются у 98% инфицированных и более стабильны, чем антитела к другим антигенам. Антитела к основным внутренним белкам ВИЧ (р17 и р24) выявляются примерно у 75% инфицированных и не чаще, чем у 50% больных с клинически выраженным СПИДом. Роль регуляторных белков и их серологическая активность нуждаются в дальнейшем изучении.
Дата добавления: 2016-04-14; просмотров: 2072;


 Леонид Марголис, один из первооткрывателей новой роли ацикловира. Фото Эмилии Ойгенблик
Леонид Марголис, один из первооткрывателей новой роли ацикловира. Фото Эмилии Ойгенблик
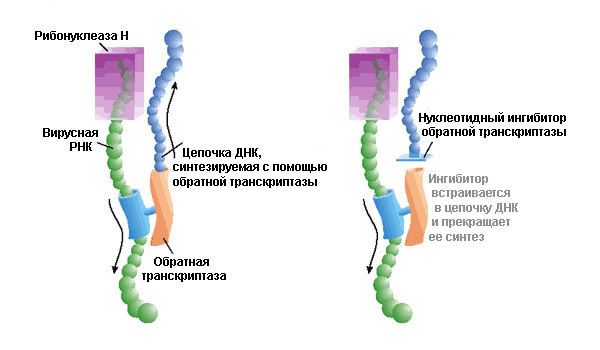 Механизм действия ингибиторов обратной транскриптазы ВИЧ-1. Как удалось показать группе Леонида Марголиса, в качестве такого ингибитора может выступать трифосфат ацикловира. Если клинические испытания подтвердят его безопасность и терапевтический потенциал, модифицированный ацикловир может стать дешевым лекарством против СПИДа. Рис. с сайта www.nature.com
Механизм действия ингибиторов обратной транскриптазы ВИЧ-1. Как удалось показать группе Леонида Марголиса, в качестве такого ингибитора может выступать трифосфат ацикловира. Если клинические испытания подтвердят его безопасность и терапевтический потенциал, модифицированный ацикловир может стать дешевым лекарством против СПИДа. Рис. с сайта www.nature.com