Различный вид и положение кратных связей
(изомеры 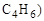
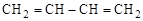
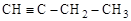
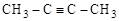
[бутадиен-1,3] [бутин-1] [бутин-2]
Обычные структурные формулы отражают только эти два (А и Б) аспекта структуры молекул.
В) ПРОСТРАНСТВЕННАЯ ИЗОМЕРИЯ (или стереоизомерия):
Такие изомеры имеют одинаковый порядок связи между атомами, но различаются по пространственному расположению входящих в их состав атомов или групп атомов. Для показа пространственной структуры используют спецприемы.
Сюда относятся:
(5) Цис-транс-Изомерия – различное расположение атомов относительно двойной связи (а) или плоскости цикла (б):
Пример (а) – стереоизомеры бутен-2:
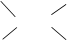
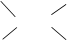
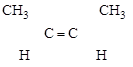
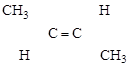
[цис-Бутен-2] [транс-Бутен-2]
Пример (б) – стереоизомеры [1,3-диметилциклобутанов]:

цис-форма транс-форма
(6) Оптическая (зеркальная) изомерия
Это явление обусловлено наличием в молекулах асимметрических атомов углерода; рассматривается в разделах «Оксикислоты» и «Углеводы».
(7) Конформационная изомерия
Понятие о конформациях и этом виде изомерии рассматривается в разделе «Циклоалканы» (см. разд. 2.7.2).
1.5. Способы записи структурных формул органических молекул
Молекулярные формулы ( 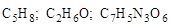 и т. п.) содержат очень мало информации для объяснения химических свойств органических соединений. Так как свойства органических молекул определяются в основном их структурой, то в органической химии главным образом используются с т р у к т у р н ы е ф о р м у л ы.
и т. п.) содержат очень мало информации для объяснения химических свойств органических соединений. Так как свойства органических молекул определяются в основном их структурой, то в органической химии главным образом используются с т р у к т у р н ы е ф о р м у л ы.
Двухэлектронная связь между атомами обозначается одним валентным штрихом, кратные связи, соответственно, двумя или тремя штрихами.
Способов записи структурных формул несколько.
1. Полная (развернутая) запись – показ всех элементов и связей между ними в молекуле:

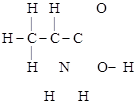
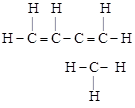 .
.
2.Компактная запись. Здесь не показываются связи водорода с другими элементами, обозначается только количество атомов водорода, связанных с этим элементом:
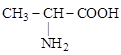
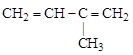
Используется также запись функциональных групп без показа их структуры (–CООH, –SО3H, –CHО, – NO2и др.). При этом соблюдается принцип непосредственной связи между атомами и функциональными группами: если группы пишутся слева, они пишутся в обратном порядке, чтобы показать, каким именно атомом они присоединяются. Исключение составляют общеизвестные радикалы ( 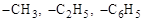 и т.д.), которые пишут одинаково и слева, и справа, подразумевая, однако, что радикал присоединен свободной валентностью:
и т.д.), которые пишут одинаково и слева, и справа, подразумевая, однако, что радикал присоединен свободной валентностью:
 |
в е р н о

н е в е р н о
3.Условная запись. Атомы С и Н вообще не изображаются, показываются лишь типы связей между углеродами и фрагменты структуры с другими атомами:
 |
означает 
|

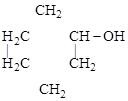 ;
; 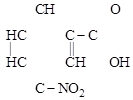
(на концах, в местах изломов и соединения линий – атомы углерода с соответствующим числу связей количеством атомов водорода).
4.Обобщенная запись – использование условных (общепринятых) обозначений типовых структурных фрагментов органических молекул:
R – любой алкил (радикал ациклического углеводорода);
Ar – любой арил (ароматический радикал);
Ас – ацильная группа 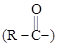 ;
;
Hal – любой галоген (F, Cl, Br, I) и др.
Например, R–СООН означает, что речь идет о любой карбоновой кислоте; используется для показа химических свойств класса соединений, обусловленных видом функциональной группы и мало зависящих от вида углеводородного радикала.
1.6. Номенклатура
Огромное число, сложность и многообразие органических соединений придают проблеме номенклатуры (способам их наименования) первостепенное значение.
Многие давно и широко используемые органические соединения имеют общеупотребимые (исторически сложившиеся)
т р и в и а л ь н ы е н а з в а н и я: этилен, ацетилен, ацетон, стирол, тротил, индол; кислоты – уксусная, яблочная, молочная, лимонная; витамин А и др. Эти названия запоминаются по мере их многократного использования. Однако далеко не все соединения имеют такие названия, а запомнить все многочисленные имеющиеся проблематично.
Для учета структуры молекул в их названии выработаны
п р а в и л а н а и м е н о в а н и я – систематические номенклатуры органических соединений. Номенклатура – способ обмена химической информацией. Задач номенклатуры две:
а) назвать соединение по его химической (структурной) формуле;
б) воспроизвести химическую (структурную) формулу по названию.
Номенклатур несколько. Принцип их использования единый: сложное соединение представляется как производное менее сложного, образованное путем замены атомов водорода в молекуле последнего на радикалы (см. разд. 2.2).
Наиболее законченная серия правил наименования органических соединений содержится в номенклатуре Международного союза чистой и прикладной химии (ИЮПАК). Есть и другие, до сих пор применяемые системы наименования соединений, используемые для сравнительно несложных молекул. Самой распространенной из них является заместительная, или рациональная номенклатура (Р. н.).
Для Р. н. соединение представляется как производное первого члена гомологического ряда соединений этого класса (метана – для алканов, этилена – для олефинов, карбинола – метилового спирта – для спиртов и т. д.).
Для М. н. (международной номенклатуры ИЮПАК) соединение представляется как производное углеводорода – наиболее длинной углеродной цепи (или цикла) в называемом соединении. Общая схема названия любого органического соединения по международной номенклатуре может быть представлена в виде:

Здесь «адреса» – номера атомов углерода основной цепи, где находятся замещающие или функциональные группы.
 Нумеруется С – цепь со стороны старшей функциональной группы. Порядок старшинства функциональных групп следующий:
Нумеруется С – цепь со стороны старшей функциональной группы. Порядок старшинства функциональных групп следующий:
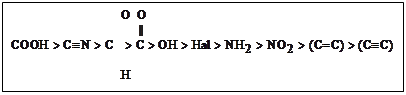 Порядок практического использования Р. н. и М. н. рассматривается при описании конкретных классов органических соединений начиная с алканов (глава 2).
Порядок практического использования Р. н. и М. н. рассматривается при описании конкретных классов органических соединений начиная с алканов (глава 2).
1.7. Виды химической связи
Атом – это система из ядра и электронов. Любая система стремится к минимуму энергии, т. е. к наиболее устойчивому состоянию. Для атома, как системы, наиболее устойчивым является состояние с «завершенным» наружным электронным слоем – п р а в и л о «о к т е т а» (для атомов первого периода – Н и Не – завершенным является двухэлектронный слой).
Все элементы, кроме инертных газов, имеют незавершенные наружные слои электронных оболочек (от 1 до 7 электронов). Стремление к завершению может быть реализовано четырьмя способами:
1) получить недостающие до октета электроны;
2) отдать внешние электроны и «обнажить» октет предвнешнего слоя электронной оболочки;
3) обобществить неспаренные электроны взаимодействующих атомов и таким образом достроить до октета электронные оболочки сразу нескольких атомов;
4) объединить готовую (неподеленную) пару электронов одного атома (донора) и свободную орбиталь электронной оболочки другого атома (акцептора).
1.7.1. Ионная связь
Первые два способа реализуются одновременно при образовании ионной связи:
|
|
 .
.
|


|
 + .Cl:Na+ + :Cl:–
+ .Cl:Na+ + :Cl:–
атом атом катион анион
Образовавшиеся сразу после переноса электрона ионы притягиваются друг к другу силами электростатического притяжения – ионная (гетерополярная) химическая связь. Такого типа связь возникает между элементами резко различного химического характера (например, между типичным металлом и типичным неметаллом), обладающими значительно различной электроотрицательностью.
1.7.2. Ковалентная связь
В состав органических молекул входят элементы со сравнительно близкими величинами электроотрицательности, и связи между этими элементами возникают путем обобществления электронов, способ 3. Каждый из соединяющих элементов предоставляет свои электроны для образования общих электронных пар:


 +
+ 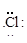
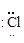
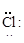
Cl – Cl (одна общая пара)

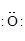


 +
+ 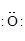
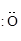
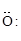 ; : N M + M N: :N N:
; : N M + M N: :N N:
(две общие пары) О = О (три общие пары) N º N
Каждый из этих атомов теперь обладает октетом электронов. Каждая из обобществленных пар электронов образует одну
к о в а л е н т н у ю (гомеополярную) химическую связь.
Ковалентная связь – наиболее распространенный в органической химии тип связи. Эта связь обладает максимальной прочностью.
1.7.3. Донорно-акцепторная связь
Такой тип связи возникает за счет объединения неподеленной электронной пары атома-донора и «пустой» орбитали атома-акцептора, способ 4.

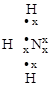 +
+ 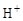
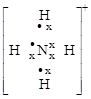

молекула ион катион аммония
аммиака водорода
На схеме (х) обозначены электроны атома азота, (·) – электроны атомов водорода.
Донорно-акцепторная связь отличается от обычной ковалентной только способом образования; по физическим и химическим свойствам они абсолютно идентичны.
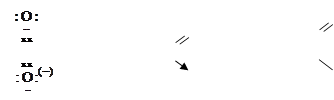
1.7.4. Семиполярная связь
Эта разновидность донорно-акцепторной связи часто встречается в молекулах органических соединений (например, в нитросоединениях, в сульфоксидах, в соединениях фосфора и др.):
а) б)
 |
 или
или 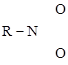 или
или 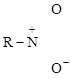
Один кислород соединен с азотом обычной двойной ковалентной связью (две общие пары электронов). Второй кислород (акцептор) образовал связь за счет неподеленной пары электронов азота (донор), при сдвиге которой у донора возникает заряд (+), а у акцептора (–).
В таком случае одинарная (двухэлектронная) донорно-акцепторная связь между атомами азота и кислорода дополняется электростатическим взаимодействием между N+ и O–, а этот тип связи называется с е м и п о л я р н ы м (т. е. полуполярная связь). Она одновременно и гомеополярная, и гетерополярная, т. е. промежуточная между ковалентной и ионной.
На структурных формулах такой вид химической связи изображается или стрелкой (а), или одним валентным штрихом с показом зарядов донора и акцептора (б) (см. выше).
1.7.5. Водородная связь
Водородная связь – результат взаимодействия молекул, содержащих сильно электроотрицательные элементы (O, N, F, реже S, Cl, Br), которые имеют свободную электронную пару, и молекул с а к т и в н ы м и атомами водорода. Активными называются атомы водорода, соединенные с другими атомами сильно полярной ковалентной связью.
Обозначается водородная связь серией точек или пунктиром:

 . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . 
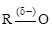 . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . 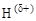
По характеру водородная связь является электростатической, ее прочность всего 1…8 ккал/моль (по сравнению, например, с 110 ккал/моль для ковалентной связи O – H). Она может быть как межмолекулярной (вода, низшие спирты и др.), так и внутримолекулярной (именно водородными связями фиксируются вторичная и третичная структуры белков и нуклеиновых кислот).
Несмотря на малую прочность, водородная связь играет огромную роль в природе, в значительной мере определяя многие свойства различных веществ.
1.8. Валентные состояния атома углерода
Определяющим будущую структуру молекулы является тип гибридизации орбиталей ее центрального атома (соединенного с несколькими другими атомами). В органической химии центральным является атом углерода (могут быть также N, О, S).
Гибридизация – образование из разных простых атомных орбиталей гибридных орбиталей, усредненных по форме и по энергиям, и ориентированных в пространстве симметрично относительно друг друга. Тип гибридизации, вид и количество возникающих при этом гибридных орбиталей определяются видом и количеством простых атомных орбиталей, вступающих в гибридизацию (см. рис. 1, 2, 3).
 Атом углерода в возбужденном состоянии имеет на втором (валентном) энергетическом уровне четыре неспаренных электрона (C*, 2sI
Атом углерода в возбужденном состоянии имеет на втором (валентном) энергетическом уровне четыре неспаренных электрона (C*, 2sI 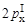
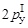
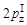 , ). Для него возможны три варианта гибридизации и, соответственно, три валентных состояния атома углерода.
, ). Для него возможны три варианта гибридизации и, соответственно, три валентных состояния атома углерода.
1.8.1. Первое валентное состояние атома углерода (sp3)
При образовании атомом углерода четырех простых (одинарных двухэлектронных) связей с другими атомами из четырех его орбиталей (одной s- и трех p-) образуются четыре гибридные sp3-орбитали, ориентированные в пространстве под тетраэдрическими углами друг к другу (рис. 1).
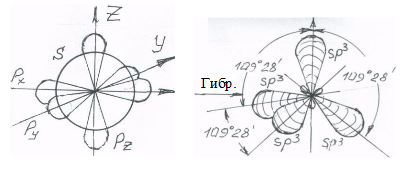
Рис. 1. sp3-гибридизация орбиталей и тетраэдрическая (объемная) ориентация гибридных sp3-орбиталей – первое валентное состояние атома углерода
1.8.2. Второе валентное состояние атома углерода (sp2)
В соединениях с двойной (четырехэлектронной) связью между атомами углерода последний связан с тремя другими атомами. В этом случае гибридизуются три орбитали (одна s- и две p-орбитали) и образуются три sp2-орбитали, ориентированные в одной плоскости под углами 120º друг к другу. Оставшаяся негибридной p-орбиталь ориентирована перпендикулярно этой плоскости – второе валентное состояние атома углерода (рис. 2).
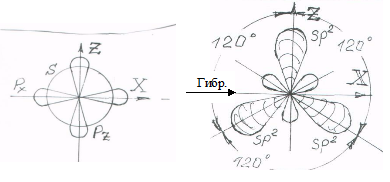
Рис. 2. sp2- гибридизация орбиталей и плоскостная (XZ) ориентация гибридных sp2-орбиталей. Негибридная pY-орбиталь ориентирована по оси
Y – второе валентное состояние атома углерода
1.8.3. Третье валентное состояние атома углерода (sp)
В соединениях с тройной (шестиэлектронной) связью (СºС) атом углерода связан только с двумя другими атомами. В этом случае у него гибридизуются две орбитали (одна s- и одна p-), и образуются две гибридные sp-орбитали, ориентированные друг к другу под углом 180 °С. Оставшиеся негибридными две
р-орбитали ориентированы перпендикулярно друг к другу и к оси ориентации гибридных орбиталей (рис. 3).
Рис. 3. sp-гибридизация орбиталей и линейная ориентация гибридных
sp-орбиталей по оси X. Негибридные p-орбитали ориентированы по осям Z и Y – третье валентное состояние углерода
1.9. s-связь и p-связь
С позиций квантово-механических представлений, химическая связь – это перекрывание орбиталей соединяющихся атомов с образованием между их ядрами областей повышенной электронной плотности. При этом взаимодействуют электроны с антипараллельными спинами.
Способов перекрывания орбиталей два: s-связь и p-связь.
s-связь – перекрывание орбиталей, при котором область повышенной электронной плотности лежит на линии связи («лобовое» перекрывание). Это одинарная двухэлектронная связь.
В образовании s-связей участвуют все типы орбиталей (и простые и гибридные) (рис. 4).
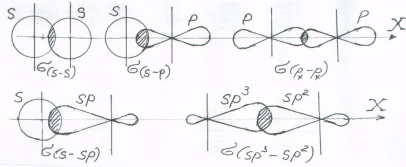
Рис. 4. Схемы образования s-связи перекрыванием орбиталей различных типов
Именно s-связь является структурообразующей. Одним из основных положений метода валентных связей является принцип максимального перекрывания орбиталей (направленность ковалентных связей). Реализуется этот принцип путем расположения соединяющихся атомов вдоль осей ориентации их гибридных орбиталей, участвующих в образовании s-связей. То есть атомы, связанные с центральным атомом, располагаются относительно него в пространстве по направлениям расположения его гибридных орбиталей, – структура молекулы определяется типом гибридизации орбиталей ее центрального атома. Хорошо иллюстрирует это структура молекулы нормального бутана (рис. 5).
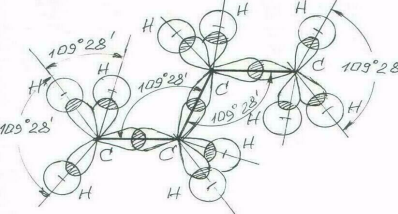
Рис. 5. Зигзагообразная форма углеродной цепи молекулы нормального бутана
p-связь – способ перекрывания орбиталей, при котором области повышенной электронной плотности не лежат на линии связи («боковое» перекрывание). В образовании p-связей участвуют только негибридные р-орбитали атома углерода. (В образовании p-связей могут также участвовать негибридные d-орбитали других атомов, у которых есть на d-орбиталях валентные электроны.)
Образуют p-связь р-орбитали двух соединяющихся атомов, ориентированные вдоль параллельных осей. Необходимо подчеркнуть, чтоp-связь – это одинарная (двухэлектронная) ковалентная связь с образованием двух областей перекрывания (рис. 6).
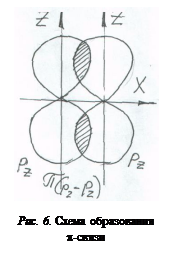 Кратная связь (двойная или тройная) осуществляется более чем одной электронной парой. Если между двумя атомами две или три связи, то одна из них обязательно s-связь, а остальные p-связи (последних может быть одна или две). Соединения с кратными связями гораздо более реакционноспособны, чем соответствующие алканы.
Кратная связь (двойная или тройная) осуществляется более чем одной электронной парой. Если между двумя атомами две или три связи, то одна из них обязательно s-связь, а остальные p-связи (последних может быть одна или две). Соединения с кратными связями гораздо более реакционноспособны, чем соответствующие алканы.
p-связь менее прочна, чем s-связь. p-электроны находятся на периферии молекулы и в первую очередь подвергаются атаке реагента. При реагировании непредельных углеводородов рвется обычно только p-связь, а s-связь сохраняется и, соответственно, сохраняется углеродный скелет молекулы. (Есть и реакции, идущие с полным разрывом кратных (С=С или СºС) связей, например, реакции жесткого окисления непредельных углеводородов.)
1.10. Взаимное влияние атомов в молекуле.
Индуктивный и мезомерный эффекты
Важнейшим разделом теории A.M. Бутлерова является положение о взаимном влиянии атомов в молекуле.
Атомы элементов, входящие в состав органических соединений, имеют различную электроотрицательность (способность атома в соединении смещать в свою сторону общую электронную пару или область повышенной электронной плотности). Величины относительных электроотрицательностей (ОЭО), по Л. Полингу, для органогенных элементов и галогенов приведены в табл. 3.
Т а б л и ц а 3
Относительные электроотрицательности элементов по Л. Полингу (ОЭО)
| Элементы | ОЭО | Элементы | ОЭО | Элементы | ОЭО* |
| Галогены (F, Cl, Br, I) | 4¸2,5 | N | 3,0 | C(sp3) | 2,50 |
| S | 2,5 | C(sp2) | 2,67 | ||
| О | 3,5 | H | 2,1 | C(sp) | 2,78 |
______________________
* ОЭО атомов углерода возрастает с изменением типа гибридизации (валентного состояния).
Из-за разных электроотрицательностей соединяющихся атомов области повышенной электронной плотности смещаются в сторону элемента с наибольшим значением ОЭО, а связь между ними становится полярной. Смещение области повышенной электронной плотности тем значительнее, чем более велика разность величин электроотрицательностей (DОЭО).
1.10.1. Индуктивный эффект (I)
Индуктивный эффект – смещение электронной плотности вдоль s-связейиз-за DОЭО связанных атомов. I-эффект является наиболее простой формой проявления взаимного влияния атомов в молекуле. По мере удаления от атома, вызывающего смещение электронной плотности, влияние индуктивного эффекта быстро ослабевает:
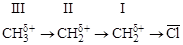
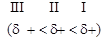
(Здесь d – доля заряда электрона, дробный заряд.)
Если смещение электронной плотности происходит от цепи в сторону заместителя, такой эффект называют отрицательным (–I). Если смещение в сторону цепи от заместителя, – это положительный (+I)-эффект.
Классическим примером (–I)-эффекта является возрастание силы уксусной кислоты СН3СООН (К=1,75×10–5) при замене атомов водорода в метильной группе на хлор: ClCH2COOH (К=1,5×10–3); Cl2CНСOOH (К=5×10–2); CСl3COOH (К=2×10–1).
 Пример (+I)-эффекта – характер распределения электронной плотности в молекулах непредельных несимметричных углеводородов, объясняющий правило В.В. Марковникова для присоединения к ним полярных молекул (Н–ОН, Н–Нal и т.п.). Метильный углерод (sp3), имея меньшую ОЭО, чем этиленовый (sp2), оказывает (+)-эффект на p-электроны двойной связи, которые легко смещаются. В результате распределение зарядов в молекуле, показанное на ниже приведенной схеме, объясняет направление присоединения:
Пример (+I)-эффекта – характер распределения электронной плотности в молекулах непредельных несимметричных углеводородов, объясняющий правило В.В. Марковникова для присоединения к ним полярных молекул (Н–ОН, Н–Нal и т.п.). Метильный углерод (sp3), имея меньшую ОЭО, чем этиленовый (sp2), оказывает (+)-эффект на p-электроны двойной связи, которые легко смещаются. В результате распределение зарядов в молекуле, показанное на ниже приведенной схеме, объясняет направление присоединения:



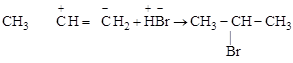
Динамический индуктивный эффект возникает в молекуле под действием реагента. Пример такого явления – пероксидный эффект Караша при присоединении HBr к непредельным углеводородам в присутствии перекиси водорода:

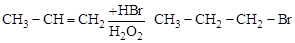 .
.
В этом случае присоединение идет вопреки правилу Марковникова (правило см. разд. 3.4.2).
1.10.2. Мезомерный эффект
или эффект сопряжения (М-эффект)
Мезомерный эффект – передача полярных эффектов через p-связи. В молекулах, в которых двойные связи чередуются с одинарными (сопряженные двойные связи), происходит перераспределение p-электронной плотности. Результатом этого является образование единого p-электронного облака (см. разд. «Диены» 4.3 и «Арены» 6.1.1).
Особенно ярко М-эффекты проявляются в сопряженных системах типа (С=С–С=Х), где в результате смещения p-электронных облаков вдоль системы на ее концах появляются разные по знаку, но одинаковые по величине заряды. Поэтому М-эффекты еще называются эффектами сопряжения:
 |

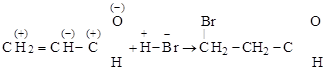 .
.
Так же как и в случае I-эффектов, бывают (+М) и (–М)-эффекты – смещение электронной плотности, соответственно, к цепи от заместителя или от цепи к заместителю (см. орто- и мета-ориентанты для бензольного кольца, разд. 6.2.2). М-эффекты также могут быть динамическими, т. е. вызываться реагентами, перераспределяющими электронную плотность в сопряженной системе.
Мезомерный эффект сопряжения передается по цепи без ослабления, в отличие от индуктивного эффекта, который довольно быстро затухает и практически сказывается только на связи, ближайшей к заместителю, вызывающему I-эффект.
1.11. Варианты разрыва связей
Практически все связи в органических молекулах ковалентные (общие электронные пары). В структурных формулах эта связь изображается парой точек или валентным штрихом. Одна связь (и s-, и p-) изображается одним валентным штрихом, кратная связь, соответственно, двумя или тремя штрихами (или парами точек).
Вариантов разрыва связей три:
а) гетеролитический донорный

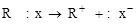
(карбокатион) (анион)
б) гетеролитический акцепторный

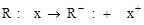
(карбанион) (катион)
Органические ионы – активные заряженные частицы, время жизни которых незначительно. Однако роль их в органической химии очень велика, так как многие реакции протекают с их участием.
в) гомолитический разрыв
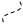
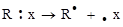
(свободные радикалы)
В этом случае пара электронов разъединяется и возникает пара свободных радикалов. Свободные радикалы – это молекулы или атомы, имеющие неспаренный (неподеленный) электрон на валентной оболочке.
Наличие свободной валентности, т. е. неспаренного электрона, придает свободным радикалам специфические свойства: высокую химическую активность, парамагнетизм и др. Это незаряженные, неустойчивые, короткоживущие частицы. Образовываться могут термически (чаще всего), радиационно (hn), под действием b- и g-излучения. С их участием протекает большинство органических реакций: галогенирования, нитрования, пиролиза, горения, взрыва, полимеризации и др.
При возбуждении молекулы этилена (при разрыве p-связи) происходит переориентация спинов спаренных p-электронов, в результате чего их спины становятся параллельными, а электроны – неспаренными (двухвалентный радикал):
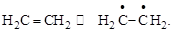
Атомы углерода при этом переходят из второго (sp2) валентного состояния – в первое (sp3).
1.12. Механизмы органических реакций
Органические реакции подчиняются, в принципе, тем же законам, что и неорганические, но имеют и специфические особенности. Так, в отличие от последних, в которых обычно участвуют ионы, в органических реакциях чаще всего участвуют молекулы. Такие реакции протекают гораздо медленнее, а для их успешного завершения часто используют катализаторы или соответствующие условия (повышают температуру или давление). Выход ожидаемого продукта при этом обычно невысок (50...80 %), так как в процессе его получения идет не одна реакция, а несколько (все их, кроме главной, называют побочными). Поэтому органическую реакцию, как правило, записывают не в виде химического уравнения, а приводят ее схему, которая показывает исходное вещество и главный продукт реакции, а также условия проведения реакции. Здесь вместо знака равенства используется стрелка, указывающая путь превращения веществ.
Механизм реакции – это последовательность всех элементарных изменений, происходящих с реагирующими молекулами в процессе химической реакции. А поскольку химическая реакция – это разрыв одних связей и образование других, механизмы реакций и включают в себя характер разрыва старых связей и способ возникновения связей новых.
В результате разрыва связей возникают промежуточные, как правило, неустойчивые короткоживущие частицы – ионы или радикалы, объединение которых и дает новые устойчивые соединения.
Механизмов образования новых соединений три.
1. Свободно-радикальный (SR)
Эти реакции идут в том случае, если атакующий реагент (Ех) – свободный радикал (частица с неспаренным электроном):
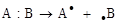 .
.
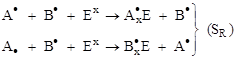 .
.
Пример радикального замещения:
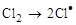 ,
,
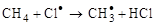 ,
,
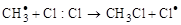 и т. д.
и т. д.
Ионные реакции идут в случаях гетеролитических вариантов разрыва связей. Объединяются центры с противоположными зарядами.
Большинство реагентов можно разделить на две категории, соответственно осуществляются два варианта механизмов ионных реакций: электрофильный (SЕ) и нуклеофильный (SN).
2. Электрофильный (SЕ)
Эти реакции идут в том случае, когда атакующий реагент – электрофильный («любящий электроны») (Е+), который использует для образования связи ту пару электронов, которая принадлежала реагирующей молекуле А:В.
Связь в молекуле А:В под действием реагента Е+ может
разрываться по двум направлениям – (1) и (2) с образованием ионов:
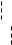
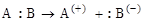 , (1)
, (1)
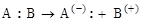 . (2)
. (2)
Вид образующихся продуктов определяется способом разрыва связи А:В – акцепторный (2) или донорный (1):
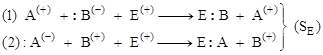 .
.
Электрофилами (Е+) являются катионы (Н+, 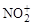 и др.) или молекулы со свободными орбиталями (AlCl3, ZnCl2 и др.).
и др.) или молекулы со свободными орбиталями (AlCl3, ZnCl2 и др.).
Пример электрофильного замещения:
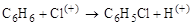 .
.
3. Нуклеофильный (SN)
В этом случае реагент (:Е–) является нуклеофилом («любящий ядро»), он имеет неподеленную электронную пару для образования связи:
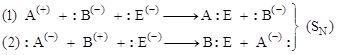 .
.
Нуклеофилами (:Е–) являются анионы (ОН–, RCOO– и др.), или молекулы с неподеленными парами электронов ( 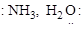 и др.).
и др.).
Пример нуклеофильного замещения:
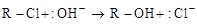 .
.
1.13. Типы органических реакций
Главное (основное) органическое вещество (участника реакции) принято называть с у б с т р а т, а второго участника –
р е а г е н т.
По результату изменений, происходящих с молекулой субстрата, реакции бывают следующих типов.
1. ЗАМЕЩЕНИЯ. В молекуле один атом (или группа атомов) замещается на другой атом (или группу атомов).
Ф о р м а л ь н о схему замещения можно представить так:
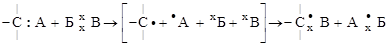
молекулы радикалы молекулы
2. ОТЩЕПЛЕНИЯ. От двух атомов молекулы субстрата отщепляются два атома (или группы атомов), объединяющихся между собой, а между атомами молекулы субстрата образуется новая связь. Если эти атомы были соседними – дополнительная связь (а); если не соседними – образуется циклическая структура (б):
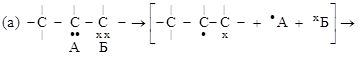
молекула радикалы
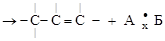
алкен продукт отщепления
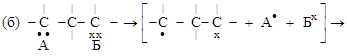
молекула радикалы
|
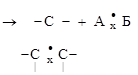
цикл
3. ПРИСОЕДИНЕНИЯ. К таким реакциям способны соединения с кратными связями (а) или с малыми циклами (б):
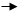
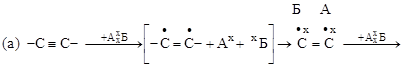
молекулы радикалы молекулы
|
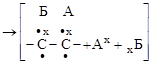
|
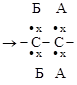
 радикалы молекула
радикалы молекула


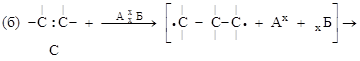
радикалы
(цикл раскрывается).
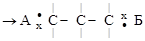
4. РАСЩЕПЛЕНИЯ (крекинга, разложения). В этих реакциях из сложных молекул образуются более простые.
СН3 – СН2 – СН2 – СН3 ® СН3 – СН3 + СН2 = СН2;
н-бутан этан этилен
НСООН ® СО2 + Н2;

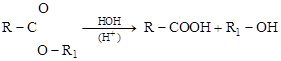 .
.
сложный эфир карбоновая спирт
кислота
5. СИНТЕЗА. В этих реакциях образуются сложные соединения из более простых. При этом объединение может происходить как с отщеплением побочных низкомолекулярных продуктов – Н2О, NH3, HHal и др. – КОНДЕНСАЦИЯ (а) и ПОЛИКОНДЕНСАЦИЯ (б), так и без образования побочных продуктов – ОЛИГО- или ПОЛИМЕРИЗАЦИЯ (в) и (г) соответственно («олиго» = «несколько», «поли» = «много»):

 (а)
(а) 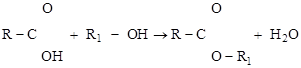 ;
;
(б) nHO – СН2 – СН2 – OН ® (– СН2 – СН2 – O –)n + nН2O;
 этиленгликоль полиэтиленгликоль
этиленгликоль полиэтиленгликоль
(в) 3НС º СН ®
ацетилен бензол
(г) nH2С = СН2 ® (– Н2С – СН2 – )n..
этилен полиэтилен
6. ПЕРЕГРУППИРОВКИ или ИЗОМЕРИЗАЦИИ. При этом происходят внутримолекулярные перемещения атомов без изменения состава молекул:
СН3 – СН2 – СН2 – СН3 
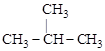
н-бутан изобутан
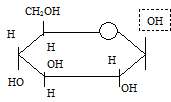




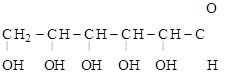
глюкоза (альдегидная форма) b–D-глюкопираноза
(циклическая форма)
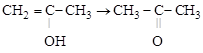
пропенол-2 ацетон
1.14. Классификация органических соединений
Наиболее прочной и малоизменяемой частью сложного органического вещества является его углеводородная часть и особенно углеродная цепь – у г л е р о д н ы й с к е л е т.
В зависимости от структуры углеродного скелета органические соединения классифицируются на три большие группы.
1. Ациклические (алифатические) соединения – скелет составлен из непосредственно связанных атомов углерода в виде неразветвленной (нормальной) цепи
СН2 – СН2 – СН2 – . . .
или разветвленной цепи
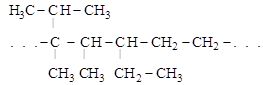
2. Карбоциклические соединения – в их молекулах углеродные цепи замкнуты в циклы:

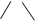




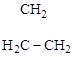
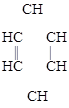
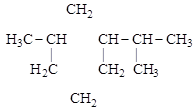
циклопропан бензол [1-метил-3-изопропилциклогексан]
3. Гетероциклические соединения – в молекулах этих соединений в цикл, кроме углерода, входят другие (гетеро-) атомы:
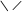

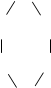
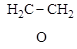
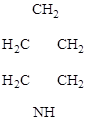
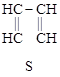
этиленоксид пиперидин тиофен
В каждой их этих групп все соединения подразделяются на классы по видам функциональных групп: спирты (–ОН), амины (–NH2), карбоновые кислоты (–СООН) и т. д.
1.15. Идентификация органических веществ
и установление их структуры
Состав и структура органических веществ устанавливаются экспериментально. Возможны две ситуации.
(А). Идентификация известного вещества. Большое количество органических соединений хорошо изучено, а свойства их описаны в литературе. Обнаружение и идентификация таких веществ осуществляется методами качественного анализа по характерным для них признакам (например, запахи уксусной кислоты или ацетона) или по внешним эффектам в результате аналитических реакций. Используется также измерение их физических характеристик (температуры плавления и кипения, плотность, растворимость, показатель преломления, различные спектры и т.д.).
Отсюда следует, что при идентификации соединений путем сравнения их свойств со свойствами известных соединений ч и с т о т а имеет первостепенное значение. Наиболее распространенные способы «сверхочистки» основаны на х р о м о т о г р а- ф и и – разделении компонентов смеси путем использования различий в их распределении между двумя фазами.
(Б). Идентификация неизвестного вещества.Установление структурной формулы неизвестного соединения представляет собой существенно иную задачу. Она состоит из двух частей:
– во-первых, определения молекулярной формулы, т. е. числа и вида атомов, содержащихся в данной молекуле;
– во-вторых, установления структуры.
Первая часть задачи решается элементным анализом: определяются процентное содержание каждого элемента и молекулярная масса вещества.
Молекулярные массы газообразных веществ могут быть установлены непосредственно путем измерения плотности их паров (плотность по водороду, плотность по воздуху). Для жидких и твердых веществ молекулярная масса определяется методами криоскопии или эбулиоскопии; для высокомолекулярных – осмометодом (см. «Курс физической и коллоидной химии») и др.
Установление структурной формулы неизвестного соединения после определения его молекулярной формулы реализуется последовательно:
1) изомерный прогноз;
2) определение вида функциональных групп химическим или спектральным анализом;
3) для установления структур сложных молекул широко используются приемы деструкции, т. е. расчленения молекулы на части меньших размеров. Характер полученных известных соединений и использованных для их получения реакций позволяет установить структуру исходного неизвестного вещества;
4) окончательной проверкой правильности определения структуры служит обычно синтез данного соединения каким-либо методом, который не вызывает сомнений. Если синтезированные таким образом и исследованные соединения оказываются идентичными по свойствам, то предположенная структура считается правильной.
Дата добавления: 2016-04-14; просмотров: 1962;
