Теория молекулярных орбиталей
Согласно теории молекулярных орбиталей молекула состоит из ядер и электронов, а не представляет собой совокупность атомов, как постулирует метод валентных связей. В молекулах электроны находятся на молекулярных орбиталях (МО). Свойства молекул зависят от их электронного строения, то есть от структуры МО. МО внутренних электронов обычно совпадают с соответствующими АО, иначе говоря, внутренние электроны в молекулах сохраняют свою атомную природу и не участвуют в образовании связей. МО внешних электронов имеют более сложное строение и часто рассматриваются как линейная комбинация внешних орбиталей атомов, составляющих молекулу. Число образующихся МО равно числу АО, участвующих в их образовании, то есть из двух АО получаем две МО, из трех АО - три МО и т.д. Энергии МО могут быть ниже (связывающие МО), равны (несвязывающие МО) или выше (разрыхляющие, антисвязывающие МО), чем энергии образующих их АО. Например, взаимодействие двух АО дает две МО: одну связывающую и одну разрыхляющую.
Условия взаимодействия АО:
1. АО взаимодействуют, если имеют близкие энергии. Чем больше разница энергий АО, тем меньше их взаимодействие.
2. АО взаимодействуют, если они перекрываются. Так внутренние АО разных атомов, располагающиеся вблизи ядер, не перекрываются и не взаимодействуют, сохраняя свою атомную природу.
3. АО взаимодействуют, если имеют соответствующую симметрию. Симметрия МО характеризуется элементами симметрии, такими как ось симметрии, плоскость симметрии и т.д. Для двухатомной молекулы АВ (или любой линейной молекулы) симметрия МО может быть:
, если данная МО имеет ось симметрии,
, если данная МО имеет плоскость симметрии,
, если МО имеет две перпендикулярные плоскости симметрии.
Если ось молекулы АВ совпадает с осью Z координат, то
-, - и - МО образуются при взаимодействии следующих АО соответственно:
-МО из s- , pz-, dz2- АО
-МО из px-, py -. dxz-, dyz-АО
-МО из dxy-, dx2-y2-АО
АО разной симметрии, например, s-АО и рx-АО, не взаимодействуют. Присутствие электронов на связывающих МО стабилизирует систему, так как уменьшает энергию молекулы по сравнению с энергией атомов. Стабильность молекулы характеризуется порядком связи n, равным
n =(nе св - nе разр)/2,
где nе св и nе разр - числа электронов на связывающих и разрыхляющих орбиталях.
Заполнение МО электронами происходит по тем же правилам, что и заполнение АО в атоме, а именно: правилу Паули (на МО не может быть более двух электронов), правилу Гунда (суммарный спин должен быть максимален) и т.д.
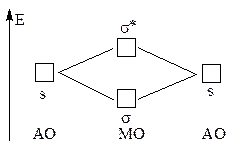
Взаимодействие 1s-АО атомов первого периода (H и Не)
приводит к образованию связывающей -МО и разрыхляющей *- МО:
Электронные формулы молекул, порядки связей п, экспериментальные энергии связей Е и межмолекулярные расстояния R для двухатомных молекул из атомов первого периода приведены в следующей таблице:
| Молекула | Электр. формула | n | Е (кДж) | R (нм) |
| Н2+ | 1 | 1/2 | 0,106 | |
| H2 | 2 | 0,074 | ||
| He2+ | 2 *1 | 1/2 | 0,108 | |
| He2 | 2 *2 | не существует |
Из приведенной таблицы видно, что знание электронной формулы молекулы и порядка в связи в ней позволяет правильно предвидеть закономерности в энергиях связей и межъядерных расстояниях. Аналогично могут быть построены МО для гомоядерных молекул из атомов второго периода, таких как Li2 и Be2.
Другие атомы второго периода содержат помимо 2s-АО также и 2рx-, 2py- и 2pz-АО, которые при взаимодействии могут образовывать - и -МО. Для атомов О, F и Ne энергии 2s и 2p АО существенно различаются и можно пренебречь взаимодействием 2s-АО одного атома и 2р-АО другого атома, рассматривая взаимодействие между 2s-АО двух атомов отдельно от взаимодействия их 2р-АО. Учитывая, что прямое перекрывание pz-pz с образованием -связи, сильнее, чем боковое перекрывание px-px или py-py с образованием -связей, то энергия z- МО будет ниже, чем энергии z- и y-МО, а энергия z-МО выше, чем энергии x*- и y*-МО. Схема МО для молекул О2, F2, Ne2 имеет следующий вид.
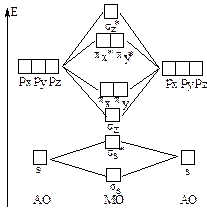
Для атомов B, C, N энергии 2s- и 2р-АО близки по своим энергиям и 2s-АО одного атома взаимодействует с 2pz-АО другого атома, в результате чего энергия связывающей s-МО понижается, а энергия z-МО повышается настолько, что становится выше энергий x- и y-МО. Поэтому порядок МО в молекулах B2, C2 и N2 отличается от порядка МО в молекулах О2, F2 и Ne2. Ниже приведена схема МО для молекул B2, C2 и N2.
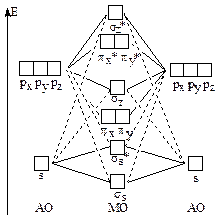
На основании приведенных схем МО можно, например, записать электронные формулы молекул О2, О2+ и О2-.
O2+(11e) s2s*2z2 (x2y2)(x*1y*0) n=2 R=0,121 нм
O2 (12e) s2s*2z2 (x2y2)(x*1y*1) n=2,5 R=0,112 нм
O2-(13e) s2s*2z2 (x2y2)(x*2y*1) n=1,5 R=0,126 нм
В случае молекулы О2 теория МО позволяет предвидеть большую прочность этой молекулы, поскольку п=2, характер изменения энергий связи и межъядерных расстояний в ряду О2+ - О2 - О2-, а также парамагнетизм молекулы О2, на верхних МО которой имеются два неспаренных электрона.
Дата добавления: 2016-04-11; просмотров: 1379;
