Типы объемных взаимодействий. Критерии устойчивости макромолекул
Полимерная цепь, где взаимодействуют только соседние звенья, сворачивается в клубок, обладающий большим числом конформаций, переходы между которыми происходят в процессе микроброуновского движения частей цепи. Такой клубок не обладает определенной внутренней структурой, он как бы все время "дышит", причем амплитуда "вздоха" порядка размеров клубка. Взаимное расположение отдельных частей клубка полностью подчиняется статистическим закономерностям. Однако если имеются объемные взаимодействия между атомами, далеко отстоящими друг от друга по цепи, то это существенно меняет всю картину. В реальных макромолекулах объемные взаимодействия элементов цепи создают внутреннее поле, под действием которого образуется глобула с плотной сердцевиной. В отличие от клубка глобула уже обладает определенной пространственной структурой. Сердцевина большой глобулы пространственно однородна с постоянной концентрацией звеньев, большей по сравнению с "опушкой" глобулы. Температурные переходы между состояниями клубка и глобулы одновременно являются переходами между разными фазами и сопровождаются изменениями агрегатного состояния макромолекулы. В биомакромолекулах наиболее подробно эти процессы изучены в белках. Белковые глобулы претерпевают переходы порядок - беспорядок в относительно малом интервале температуры и напоминают в этом отношений фазовые переходы 1 - го рода.
Типы объемных взаимодействий. Первичная структура полимерной цепи определяется химическими или валентными взаимодействиями. Объемные взаимодействия в основном определяют вторичную структуру макромолекул. Общим критерием стабильности молекулярной структуры является наличие минимума на кривой U(r) зависимости энергии взаимодействия от расстояния между взаимодействующими частями. Картинка «Электронный терм для двухатомной молекулы». 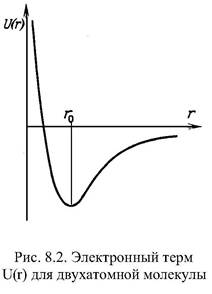
На малых расстояниях преобладают силы отталкивания, а на больших расстояниях превалирует притяжение. При r = ro силы притяжения и отталкивания уравновешивают друг друга. Значение энергии U(r) свободных частиц при r -> к бесконечности равно нулю, а энергия образованной ими стабильной структуры отрицательна U(ro) < 0. На малых расстояниях, где частицы отталкиваются, U(r) > 0. Минимум U(r0) соответствует максимальной по абсолютной величине и отрицательной по знаку энергии взаимодействия. В образовании вторичной структуры белка играют большую роль силы Ван-дер-Ваальса. Они имеют электромагнитную природу и связаны с взаимодействием электрических диполей в соседних молекулах. Наиболее распространены дисперсионные взаимодействия между молекулами, которые не обладают постоянными дипольными моментами. Природа этих сил носит квантовомеханический характер.
Неопределенности в значениях координаты дельта х и импульса дельта р связаны соотношением неопределенностей
дельта х дельта р = h
Это значит, что и в основном невозбужденном состоянии существуют быстрые смещения заряда электрона от положения равновесия, а следовательно, в молекуле в состоянии покоя появляются "мгновенные" дипольные моменты. Появление такого момента в одной молекуле индуцирует появление его в соседней молекуле. Возникает взаимодействие двух быстроменяющихся дипольных моментов, которые, таким образом, становятся связанными и притягиваются друг к другу. Энергия притяжения двух мгновенных диполей, или энергия дисперсионного взаимодействия, быстро убывает с расстоянием Uдисп~1/r6.
Кроме дисперсионного взаимодействия возможно и электростатическое притяжение между постоянными диполями в полярных молекулах. Кроме того, существуют также индукционные взаимодействия, которые возникают между постоянным дипольным моментом в одной молекуле и наведенным им диполем в соседней поляризуемой молекуле. Суммарное ван-дерваальсово взаимодействие двух молекул зависит от вклада всех типов дипольных взаимодействий и составляет по величине от 1,0 до нескольких десятков ккал/моль.
В выражении для полной энергии или полного потенциала взаимодействия необходимо учесть не только притяжение Uпритяж(r)~1/r6, но и отталкивание на близких расстояниях Uотт(r)~1/r12) сложение этих величин дает формулу на картинке 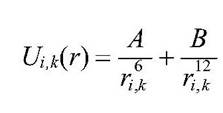 ,
,
где В - константы притяжения и отталкивания, r,k - расстояние между взаимодействующими атомами (i и k).
Наряду с силами Ван-дер-Ваальса большую роль в стабилизации биоструктур играют водородные связи и электростатические взаимодействия между заряженными и полярными группами. Водородные связи, например, стабилизируют вторичную структуру полипептидных цепей. В энергию водородной связи дают вклад электростатические взаимодействия, притяжение и отталкивание, а также энергия делокализации электронов. Величины энергии водородной связи сильно варьируют (3 - 8 ккал/моль). Так, водородная связь
О-Н ... О обладает энергией 8,6 ккал/моль.
Электростатические взаимодействия задаются формулой 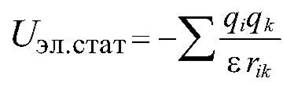 ,
,
где qi, qk - заряды на атомах (i и k), rik - расстояние между атомами, эйпсилон - диэлектрическая постоянная.
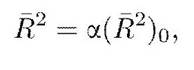 Условия существования клубка и глобулы. Вследствие объемных взаимодействий сблизившиеся участки могут либо притягиваться, либо отталкиваться друг от друга. Повышение температуры приводит к увеличению отталкивания между мономерами, понижение — способствует их взаимному притяжению. Существует температура, при которой отталкивание мономеров полностью компенсируется их взаимным притяжением. Эта температурная точка называется тета-точкой или тета-температурой. В тета-точке объемные взаимодействия отсутствуют, и макромолекула представляет собой клубок с размерами R ~ lN1/2, который сохраняется и при повышении температуры Т > тета. Однако в области Т > тета из-за увеличения сил отталкивания размеры клубка возрастают: R > lN1/2. где а — коэффициент набухания макромолекулы; а > 1 в области Т > тета и а = 1 при Т = тета.
Условия существования клубка и глобулы. Вследствие объемных взаимодействий сблизившиеся участки могут либо притягиваться, либо отталкиваться друг от друга. Повышение температуры приводит к увеличению отталкивания между мономерами, понижение — способствует их взаимному притяжению. Существует температура, при которой отталкивание мономеров полностью компенсируется их взаимным притяжением. Эта температурная точка называется тета-точкой или тета-температурой. В тета-точке объемные взаимодействия отсутствуют, и макромолекула представляет собой клубок с размерами R ~ lN1/2, который сохраняется и при повышении температуры Т > тета. Однако в области Т > тета из-за увеличения сил отталкивания размеры клубка возрастают: R > lN1/2. где а — коэффициент набухания макромолекулы; а > 1 в области Т > тета и а = 1 при Т = тета.
В хороших растворителях притяжение атомов цепи и растворителя больше, чем между атомами цепи, что равносильно увеличению их взаимного отталкивания в таком растворителе (область Т > тета; здесь а > 1). Наоборот, в плохих растворителях взаимное притяжение звеньев полимера больше, чем их притяжение к молекулам растворителя (область Т < тета; а < 1). В области Т < тета в объемном взаимодействии превалируют силы притяжения, которые могут привести к конденсации полимерного клубка в плотную слабо флуктуирующую глобулу. Эта глобула стабилизируется самосогласованным сжимающим полем, обусловленным силами притяжения между мономерами.
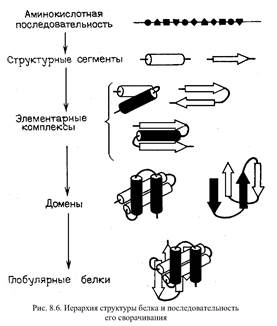 Общая топография белковой глобулы определяется тем, что полярные группы расположены в основном на поверхности, а неполярные находятся внутри глобулы и образуют ее гидрофобное ядро. На поверхностях основных элементов вторичной структуры альфа - спиралей и бета - структур также имеются целые гидрофобные области. Внутримолекуярные водородные связи между пептидными группами максимально насыщены и стабилизируют глобулу.
Общая топография белковой глобулы определяется тем, что полярные группы расположены в основном на поверхности, а неполярные находятся внутри глобулы и образуют ее гидрофобное ядро. На поверхностях основных элементов вторичной структуры альфа - спиралей и бета - структур также имеются целые гидрофобные области. Внутримолекуярные водородные связи между пептидными группами максимально насыщены и стабилизируют глобулу.
Картинка 2. На ранних стадиях сворачивания в развернутой цепи образуются альфа - или бета - участки вторичной структуры за счет локальных взаимодействий. Затем эти участки стабилизируются в результате действия гидрофобных сил, водородных связей и объемных взаимодействий с другими участками цепи с образованием уже третичной структуры. Самосборка структуры белка носит направленный кооперативный характер. Она протекает через определенное число промежуточных стадий, а не путем перебора всех возможных вариантов укладки до достижения минимального по энергии состояния. Реальное время сворачивания белковой глобулы - несколько секунд.
Выгодные низкоэнергетические состояния появляются сразу на ранних этапах сворачивания в небольших участках цепи, включающих два - три остатка. Вначале для расчета низкоэнергетической конформации белка находят низкоэнергетические состояния дипептидов. Низкоэнергетические формы трипептидов представляют собой комбинации низкоэнергетических форм смежных дипептидов, что является результатом согласованности три - и дипептидных взаимодействий. Конформационный анализ более сложных олигопептидов проводится методом последовательного увеличения цепи на один остаток. Важно, что новые взаимодействия, возникающие при удлинении цепи, стабилизируют фрагмент и не нарушают уже сложившихся взаимодействий и низкоэнергетических форм. В настоящее время такой полуэмпирический метод расчета дает возможность определить пространственную структуру достаточно сложных полипептидов, включающих до сотни остатков.
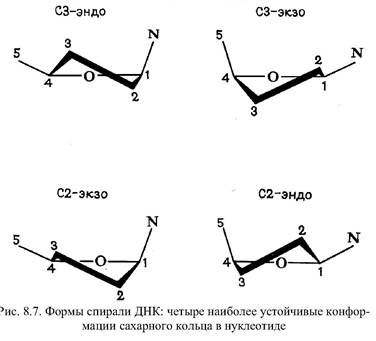 Особенности пространственной организации нуклеиновых кислот. Структура ДНК более стабильна. Тепловые флуктуации не приводят к разрыву водородных связей и не меняют межплоскостные расстояния между основаниями. В моделях жесткость служит основным параметром. Двойная спираль ДНК обладает общей жесткостью по длине спирали и одновременно ограниченным числом вращательных степеней свободы вокруг единичных химических связей. Все конформации ДНК относятся либо к А- , либо к В - формам. В случае В - форм ось спирали проходит через пары оснований вблизи их центра тяжести, а в А - форме в центре остается отверстие около 4 Е, а основания оттеснены к периферии молекулы. Конформация мономера нуклеиновой кислоты задается конформацией сахарного кольца, пятью двугранными углами вращения вокруг единичных связей в сахарофосфатной цепи и одним углом х, определяющим ориентацию основания относительно сахарного кольца. Различие А - и В - форм состоит в том, что у А - формы отличаются значения угла х и угла поворота т(тау) между соседними парами, а также большие значения расстояния D пары от оси спирали. Картинка 3.
Особенности пространственной организации нуклеиновых кислот. Структура ДНК более стабильна. Тепловые флуктуации не приводят к разрыву водородных связей и не меняют межплоскостные расстояния между основаниями. В моделях жесткость служит основным параметром. Двойная спираль ДНК обладает общей жесткостью по длине спирали и одновременно ограниченным числом вращательных степеней свободы вокруг единичных химических связей. Все конформации ДНК относятся либо к А- , либо к В - формам. В случае В - форм ось спирали проходит через пары оснований вблизи их центра тяжести, а в А - форме в центре остается отверстие около 4 Е, а основания оттеснены к периферии молекулы. Конформация мономера нуклеиновой кислоты задается конформацией сахарного кольца, пятью двугранными углами вращения вокруг единичных связей в сахарофосфатной цепи и одним углом х, определяющим ориентацию основания относительно сахарного кольца. Различие А - и В - форм состоит в том, что у А - формы отличаются значения угла х и угла поворота т(тау) между соседними парами, а также большие значения расстояния D пары от оси спирали. Картинка 3.
Кроме того, альтернативная геометрия сахарного кольца у А - и В - форм определяется тем, какой из атомов углерода выдвинут из плоскости сахарного кольца. Наличие столь большого числа внутренних степеней свободы позволяет рассматривать процесс изменения конформации двойной спирали как непрерывный. Но для регулярной спирали существует только ограниченное число конформаций сахарофосфатного остова. Энергия А - форм в целом выше, а ширина энергетической ямы уже, чем у В - форм. Это является следствием того, что расстояние между одноименно заряженными фосфатами одной и той же цепи примерно на 1Е короче в А - формах. Полный учет всех взаимодействий показывает, что В - форма является единственной устойчивой формой ДНК.
В последние годы получены данные о существовании так называемой z - формы ДНК, в которой спираль с антипараллельными нитями закручена влево, а повторяющаяся единица содержит не один, а два нуклеотида.
| <== предыдущая лекция | | | следующая лекция ==> |
| | |
Дата добавления: 2016-04-11; просмотров: 2965;
