Активный транспорт кальция
Са -зависимая АТФаза, сопряженная с мощным Са -насосом, локализована в мембранах саркоплазматической сети. состоит из полипептидной цепи с молекулярной массой около 100000 и высоким содержанием гидрофобных аминокислот .Для работы тоже надо фосфолипиды
Схема
1 связывание Са и АТФ. Эти соединения связываются с разными центрами на внешней поверхности мембранного пузырька.
2 АТФ гидролизуется с образованием фосфорилированного фермента. Образование фермент-фосфатного комплекса можно обнаружить по включению в белок радиоактивного изотопа 32Р из АТФ, меченной по фосфату. Образующаяся фосфорилированная форма фермента Е~Р конформационно неустойчива и претерпевает изменение пространственной структуры так, что ион-связывающие участки оказываются отделенными от внешней среды. Изменение конформации Са +-АТФазы проявляется в изменении сигнала ЭПР спиновой метки, присоединенной к белку, в связи с изменением подвижности метки.
3 изменение сродства Са -связывающих центров к ионам Са одновременно с изменением характера связи фосфатной группы с ферментом. Энергия, ранее сосредоточенная в макроэргической фосфатной связи комплекса Е~Р, расходуется на изменение константы связывания ионов Са с ферментом.
ионы Са получают доступ во внутреннее пространство мембранных пузырьков и выбрасываются во внутренний объем. Константа связывания Са + при образовании стабильной фосфорилированной формы фермента уменьшается от 107 до 103 М-1.
в ходе реакции AGo, т. е. AGo = —RT In К, можно найти, что изменение свободной энергии при уменьшении константы связывания от 107 до 104 М^1 составляет 17,8 кДж/моль. Т.е. суммарные
затраты энергии на перенос Са через мембрану примерно вдвое меньше энергии гидролиза АТФ (около 40 кДж/моль при рН 9), которой хватает на перенос двух ионов Са. Вследствие десорбции Са2+ с фермента суммарный положительный заряд в ион-связывающей полости уменьшается, что значительно облегчает десорбцию фосфата. В результате этих превращений фермент вновь приходит в исходное состояние.
Транспорт протонов
Перенос Н+ через мембраны может осуществляться механизмами трех типов.
В некоторых мембранах существуют подвижные переносчики протонов (пла-
стохинон в фотосинтетической мембране хлоропластов).
Возможны также конфор-
мационные переходы мембранного белка при связывании протона на одной стороне
мембраны и депротонировании белка с другой стороны мембраны, сопряженные с
поворотом макромолекулы в мембране, при котором присоединенный протон пере
секает мембрану.
могут транспортироваться через мембрану по
специализированным структурам — Н+-каналам(образован гидрофобной частью субъединицы сопрягающего фактора — комплексом CFq)Протонный канал представляет
собой узкую полость, образованную полярными группами белка.
Транспорт протонов по Н+-каналам обычно сравнивают с переносом Н+ по регулярной решетке, образованной системой водородных связей, аналогичной таковой во льду.
По Н+-каналу протоны поступают к каталитическому участку транспортной системы, в котором осуществляется сопряжение переноса Н+ с реакциями синтеза-гидролиза АТФ. Таким образом, основными узлами Н+-насосов являются протонный канал и активный центр
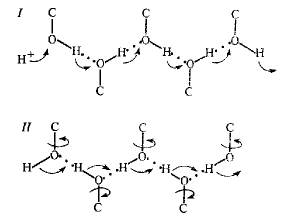 Проведение протона по цепи Н-связей: (СМ РИСУНОК)
Проведение протона по цепи Н-связей: (СМ РИСУНОК)
1 — стадия перескока протона, 11 — стадия поворо- та групп (миграция поворотного дефекта)
Эстафетная передача протонов возможна лишь при чередовании стадий перескока протона и поворотов химических связей в области образовавшегося дефекта Как видно из рисунка, транслокация одного протона по цепи протекает в две стадии. Сначала происходит перескок протона от группы к группе а затем поворот группы (на рис вышеповорот вокруг связи С—О), в результате которого происходит дополнительное смещение заряда, и система связей возвращается в исходное состояние. В результате поворота химической группы или молекул воды образуется конфигурация, не допускающая возврата протона в начальное положение.
Дата добавления: 2016-04-11; просмотров: 1529;
