А-спирали изображены в виде цилиндров, а В-структуры— в виде изогнутых стрелок
молекула АТФ расположена оптимально для переноса PY фосфатного остатка на белковый домен и фосфорилирование аспартат-369. Перенос PY на аспартат-369 -лизином, обр доп стабилизир контакты с О2 остатка PY. Конформационный переход Е1 ~ Е2 связан с взаимодействием в области каталитического центра пептидных участков 145-285 и 342-779.
Схема обмена ионами (рабочий цикл димера Na+-насоса в режиме обмена Na+/K+ (СМ РИСУНОК)
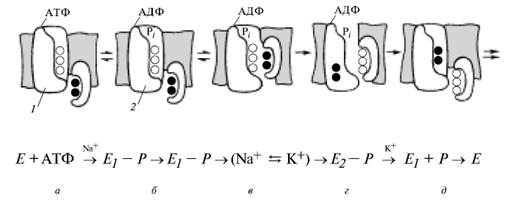
а) связывание Na+ и К+ в полостях субьединиц, б) Na-зависимое фосфорилирование большой субъединицы, б), з) обмен катионами между субъединицами, д) К^-зависимое дефосфорилирование и выброс ионов;
1 — большая субъединица, 2 — малая субъединица; полыми кружками изображены Na~*~, зачерненными — К+; Pi — фосфат, Е — фермент
На рис. Выше- последовательность превращений функционального димера Na , К+-АТФазы, основанная на конформационных превращениях и обмене ионов Na и К в полости белка. Ионообменная полость открывается с внутренней поверхности мембраны, а внешний вход в эту полость (канал) закрыт гидрофобным контактом липидов и белков. Гидролитический центр расположен на большой субъединице с внутренней стороны мембраны. Большой а-полипептид пронизывает мембрану, а гликопротеин (малая р-субъединица) расположен на ее наружной стороне. В исходном состоянии ионообменные полости субъединиц могут заполняться катионами только из примембранных слоев. Эти полости из-за стерических затруднений могут вмещать три иона Na и лишь два иона К.
Присоединение АТФ индуцирует конформационные изменения, в результате которых сродство большой субъединицы к Na значительно возрастает.
Одновременно увеличивается и эффективный отрицательный заряд ионообменной полости за счет близко расположенной отрицательно заряженной фосфатной группы АТФ. В результате последующих конформационных перестроек три иона Na оказы-
ваются замкнутыми в ионнообменной полости большой субъединицы. На этой
стадии сродство большой субъединицы к Na+ понижается, а к К+ повышается.
Состояние _Е~Р энергетически невыгодно, и фермент переходит из «напряженного»
состояния в стабильное состояние Е—Р. Дальнейшее протекание реакции и обмен ионов связаны с участием малой субъединицы. Предполагается, что субъединицы димера могут незначительно смещаться друг относительно друга в результате тепловых флуктуации. Когда полость малой субъединицы совмещается с полостью большой субъединицы, между ними может происходить обмен катионами.
Замена трех ионов Na на два иона К в большой субъединице (стадия в-г) вновь
приводит к возникновению конформационно-неравновесного состояния систе
мы. Уменьшение числа положительных зарядов в полости большой субъединицы со
провождается исчезновением большого активационного барьера, препятствующего
дефосфорилированию фермента и отщеплению отрицательно заряженной фосфат
ной группы. При этом происходит открывание полости большой субъединицы во
внутриклеточную среду. После диссоциации АДФ и Pj фермент возвращается в
исходное состояние. □
Изменение сродства ион-связывающих центров может быть обусловлено изменением их геометрии при связывании АТФ, а также при фосфорилировании и дефосфорилировании фермента. Катионы, находясь в ион- связывающих полостях, образуют координационные связи с кислородсодержащими группами полипептидных цепей. При перестройке анионного окружения катионов происходит замещение ионов одного вида на другие катионы.
Дата добавления: 2016-04-11; просмотров: 1022;
