Принцип Франка - Кондона и законы флуоресценции. Люминесценция биологически важных молекул. Механизмы миграции энергии.
Фотопроцессы в биологических системах сопровождаются возникновением электронно-возбужденных состояний, характеризующихся определенной энергией, временем жизни, структурными свойствами.
Полная энергия состояния молекулы Е складывается из энергии электронного возбуждения Ее, колебательной энергии Еv и вращательной энергии Er. Таким образом, при поглощении кванта света молекулой полное изменение энергии можно представить в следующем виде: ашню = дельта Ее + дельта Еv + дельта Er . Энергия вращательных квантов меньше, чем колебательных, а их энергия, в свою очередь, меньше энергии электронных (Er 10 в10 Гц, Еv 10 в 13 Гц, Ее 10 в 18 Гц).
Возможные электронные переходы и энергетические состояния молекулы обычно представляются в виде схемы уровней энергии (Яблонского), где каждый электронный уровень расщепляется на ряд колебательных подуровней, а каждый колебательный — на ряд вращательных подуровней (рис. 1)
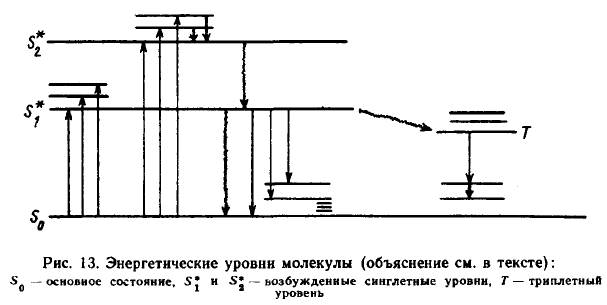
При поглощении кванта света молекулой осуществляется переход с самого нижнего колебательного подуровня основного состояния (комнатная температура) на возбужденные уровни S1* и S2*, характеризующиеся колебательными и вращательными подуровнями. В молекулах большинства соединений при возбуждении электронных состояний, расположенных выше S1*, происходит быстрая внутренняя конверсия (с временами порядка 10 в -13 с) за счет перехода с нижнего колебательного подуровня верхнего состояния S2* на верхний колебательный подуровень нижнего состояния S1* с последующей релаксацией (порядок 10 в -12) на самый нижний колебательный подуровень возбужденного состояния S1*. Это означает, что в какое бы возбужденное состояние ни попала молекула (например, в состояние S2*), в течение 10 в -13 — 10 в -12 с она перейдет на нижний колебательный подуровень первого электронного состояния S1*. Именно с этого уровня при переходе на любой колебательно-вращательный подуровень основного состояния S0 и происходит излучение — флуоресценция.
Отсюда следует, что спектр флуоресценции I=f(лямбда), т.е. зависимость интенсивности флуоресценции от длины волны и квантовый выход флуоресценции фи=число квантов фл/число погл квантов не зависят от длины волны возбуждающего света. Независимость спектра и квантового выхода флуоресценции от энергии поглощенного молекулой кванта называется законом Вавилова.
Поскольку энергия поглощенного кванта частично растрачивается на тепловые колебания, энергия кванта флуоресценции оказывается меньшей, т. е. спектр флуоресценции сдвинут в длинноволновую сторону относительно наиболее длинноволновой полосы поглощения (закон Стокса ) (т.к. E=hc/лямбда, чем меньше энергия, тем длиннее лямбда). Если что рисуем 2 гладких холма, где правый – спектр флуоресценции, а левый – поглощения. Форма полос флуоресценции определяется распределением колебательных подуровней основного состояния, т. е. отражает колебательную структуру основного состояния S0.
Часто распределение колебательных подуровней по энергиям у основного и возбужденного состояний одинаково; следовательно, полосы флуоресценции и поглощения будут зеркально симметричны относительно так называемого (0 — 0)-перехода (единственный переход, имеющий одинаковую энергию поглощения и флуоресценции).
Принцип Франка – Кондона: электронные переходы в молекулах происходят очень быстро (около 10 в -15 с) по сравнению с движением ядер, благодаря чему расстояние между ядрами и их скорости при электронном переходе не успевают измениться. Существует несколько дополнительных формулировок этого принципа: электроны не обмениваются энергией с ядрами; электроны всегда имеют равновесную конфигурацию при любом расположении ядер. Зависимость потенциальной энергии системы от координат ядер многоатомной молекулы в основном и возбужденном состояниях различается. В наиболее простом случае (двухатомная молекула) минимумы кривых потенциальных энергий в основном и возбужденном состояниях сдвинуты, поскольку орбиталь, заполняемая электроном в возбужденном состоянии, занимает большую область пространства, чем в основном состоянии, и положение равновесия в возбужденном состоянии, следовательно, соответствует большему межъядерному расстоянию (поэтому сдвиг). Кроме того, форма таких потенциальных кривых в основном и возбужденном состояниях также различается (рис. 2).
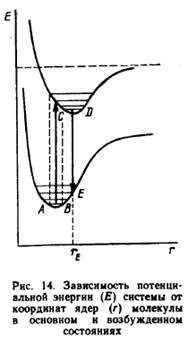
В соответствии с принципом Франка — Кондона наиболее вероятным будет такой переход, при котором не произойдет изменений ни в положении ядер, ни в импульсе (принцип вертикальности перехода между двумя электронными состояниями). Решение волнового уравнения показывает, что хотя при поглощении кванта света возможны различные переходы, однако наиболее вероятным будет переход, обозначенный сплошной стрелкой вверх на рис. 2. Иными словами, наиболее вероятное межъядерное расстояние для молекулы с нулевой колебательной энергией соответствует середине АВ. В случае флуоресценции наиболее вероятным будет испускание из середины CD (сплошная стрелка вниз), что соответствует наиболее интенсивной полосе спектра. Флуоресценция происходит с самого нижнего колебательного уровня первого возбужденного состояния при переходе молекулы в основное состояние. Вероятность перехода из возбужденного в основное состояние может быть описана константой скорости перехода k, которая по физическому смыслу эквивалентна константе мономолекулярной реакции. Кинетика перехода может быть описана реакцией первого порядка dS*/dt=-kS*, где S* - количество возбужденных молекул. После интегрирования волшебным образом I=Io*exp(-kt), k – константа флуоресценции.
При отсутствии безызлучательных процессов (фи= 1) длительность пребывания молекулы в возбужденном состоянии определяется радиационным, или естественным, временем жизни тау0=1/константу флуоресценции. Это то время, в течение которого число возбужденных молекул уменьшается в e раз. В реальных ситуациях квантовый выход обычно меньше единицы, поскольку с флуоресценцией конкурируют безызлучательные процессы: интеркомбинационная конверсия с переходом в триплетное возбужденное состояние, сопровождающееся изменением спина, внутренняя конверсия, диссипация в тепло, фотохимическая реакция или дезактивация за счет тушения флуоресценции при взаимодействии с молекулами тушителя Q.
В действительности квантовый выход флуоресценции меньше единицы вследствие существования в молекуле безызлучательных процессов; следовательно, реальное (или измеряемое) время жизни тау флуоресц окажется меньше тау): 1/сумму констант происходящих процессов (флуоресценция, фотосинтез, интеркомбинационная конверсия в триплетное состояние, диссипация в тепло (внутренняя конверсия), тушение*[Q]). Квантовый выход флуоресценции в этом случае выражается соотношением: фи=константа флуоресценции/сумму констант происходящих процессов, т.е. Фи=константа флуоресценции*время жизни.
В отсутствие тушителя квантовый выход флуоресценции обозначают как фи фл0. Фи фл0/фи фл= 1 + константаq*[Q])/сумму всех констант без тушителя, то, обозначив время жизни в отсутствие тушителя через тау фл0 (не путать с тау0 которая вообще без побочных процессов), получим, что тау фл0 =1/ сумму всех констант без тушителя и (фи фл0/фи фл)–1= тау фл0* константаq*[Q]=K[Q]. I=I0/(1+ K[Q]). Последнее уравнение называется соотношением Штерна и Фольмера, а К — константой тушения. Последняя легко определяется экспериментально при измерении интенсивностей флуоресценции различных образцов, отличающихся концентрацией тушителя. Для этого достаточно оценить угловой коэффициент прямой в координатах I без тушителя/(Iс тушителем - 1) и [Q].
Исходя из определения квантового выхода флуоресценции фи=I фл/(I0-Iпрошедшего через объект), с использованием закона Ламберта — Бэра можно установить связь между интенсивностью флуоресценции I и молярным коэффициентом поглощения, а также концентрацией с: I=K*I0*(1-Т)*фи, где I0— интенсивность возбуждающего света, (1 — Т) — величина поглощения, Т — величина пропускания, К — коэффициент пропорциональности, зависящий от способа измерения.
Так как D= - lg Т = эпсилон*с1, где D — оптическая плотность, то I=K*I0*(1-10 в степени -D)*фи. Выражение в скобках можно разложить в ряд при небольших значениях D и ограничиться линейным членом: I примерно=2,3K*I0*эпсилон*cl*фи
Это означает, что при малых оптических плотностях (меньше 0,1-0,2) I пропорциональна концентрации флуоресцирующего вещества и интенсивности возбуждающего света.
Точное измерение интенсивности флуоресценции осложняется целым рядом факторов: реабсорбцией флуоресценции, экранированием возбуждающего света другими молекулами, светорассеянием, гетерогенностью объекта, миграцией энергии, тушением флуоресценции. При комнатной температуре квантовый выход флуоресценции хлорофилла в нативных фотосинтетических мембранах составляет не более 3%. Низкотемпературная техника может ослабить влияние возбуждающего света, вызывающего побочные процессы. Флуоресценция хлорофилла в нативных фотосинтетических мембранах продуцируется молекулами хлорофилла антенны и при комнатной температуре характеризуется главным максимумом 684-687 нм и «плечом» в более длинноволновой области около 720-730 нм. В случае целых листьев из-за реабсорбции доля длинноволновой полосы возрастает. При комнатной температуре квантовый выход для фотосистемы 1 в несколько раз меньше, чем для фотосистемы 2.
Люминесценция — «холодное» свечение некоторых веществ (люминофоров); излучение, представляющее собой избыток над тепловым излучением тела при данной температуре и имеющее длительность, значительно превышающую период световых волн. Характеристики: спектр возбуждения, спектр люминесценции, квантовый выход, время жизни молекулы в возбужденном состоянии. Она делится на уже описанную флуоресценцию (быструю люмин) и фосфоресценцию (медленную люмин). Фосфоресценция – переход с нижнего колебательного уровня триплетного состояния T1 на основное возбужденное (время жизни возбужденного состояния при фосфоресценции составляет порядка 10 в −2 – 10 в −4 с, т.к. синглет-триплетные переходы имеют квантово-механический запрет – так может делать хлорофилл). Механизмы миграции хорошо отражает рис 3 и описанные ранее процессы.
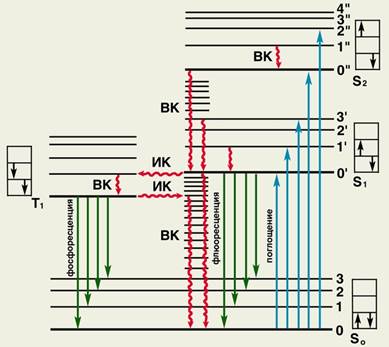
Рис. 3. Схематическое изображение физического механизма люминесценции: жирными горизонтальными линиями обозначены энергетические состояния молекулы люминесцирующего вещества; S0 — основное (невозбужденное) состояние; S2, S2 и Т1 — возбужденные состояния; тонкими горизонтальными линиями обозначены колебательные уровни (0, 1, 2.,. или 0’, 1’, 2’ и т.д.); в прямоугольниках показано направление спина возбужденного электрона (слева) по отношению к спину оставшегося электрона; ВК — внутренняя конверсия (переходы электрона без обращения спина); ИК — интеркомбинационная конверсия (переходы электрона с обращением спина). При поглощении энергии молекула переходит в возбужденное состояние S1 или S2 (обозначено синими вертикальными стрелками). Часть поглощенной энергии преобразуется в тепло (обозначено волнистыми стрелками), при этом молекула переходит на нижний колебательный уровень состояния S1 или трансформируется в состояние Т1 Возвращение молекулы из состояния S1 или Т1 на исходный энергетический уровень может сопровождаться излучением света — флюоресценцией (обозначена темно-зелеными стрелками) или фосфоресценцией (обозначена светло-зелеными стрелками).
Люминесценция биологических объектов может быть собственной (первичной) либо возникать после соответствующей химической модификации имеющихся веществ (вторичная), а также после введения так называемых флюоресцентных зондов.
Флюоресцирующие соединения могут быть определены в очень низких концентрациях, часто в присутствии посторонних веществ. Поэтому регистрация люминесценции успешно используется для количественного определения многих биологически важных веществ. Одним из наиболее ярко флюоресцирующих лекарственных соединений является хинин. В кислых растворах он люминесцирует в синей области (450—475 нм). Чтобы определить его в плазме крови проводят осаждение белков метафосфорной кислотой и измеряют люминесценцию хинина прямо в фильтрате. Яркой синей флюоресценцией обладает противогрибковый препарат гризеофульвин, он легко определяется в экстрактах из крови или мочи. Барбитураты в щелочной среде обладают яркой зеленой флюоресценцией, их можно определить в экстрактах из биологического материала. После экстракции возможна количественная регистрация многих витаминов, например витамина Е, максимум флюоресценции которого лежит в УФ-области при 330 нм. Витамин В6 имеет синюю, а витамин А — зеленую флюоресценцию. Витамины С, D, В12 и др. удается определить по вторичной люминесценции. Наркотические вещества морфин и героин флюоресцируют очень слабо, но после обработки образцов серной кислотой с последующим выщелачиванием возникает специфическая интенсивная синяя флюоресценция продуктов реакции. Этим методом удается определить до 0,02 мкг наркотика в пробе. Чувствительным лабораторным методом определения АТФ является регистрация хемилюминесценции в присутствии люциферина и люциферазы светлячка. Люцифераза катализирует реакцию восстановленного люциферина с АТФ; продукт этой реакции — аденилат при окислении испускает свет. По собственной люминесценции проводят контроль качества пищевых продуктов. Так, при длительном хранении молока и сливок рибофлавин окисляется в люмихром, что сопровождается изменением цвета флюоресценции от желто-зеленого к синему. Яйца, зараженные некоторыми видами бактерий рода Pseudomonas, при УФ-облучении начинают интенсивно флюоресцировать (за счет пигмента пиовердина, синтезированного этими бактериями).
Регистрацию люминесценции используют в целях диагностики. Характерная первичная люминесценция желто-зеленого цвета, возбуждаемая УФ-облучением при 365 нм, наблюдается в волосах, пораженных паразитическими грибками.
Регистрация люминесценции позволяет получать важную информацию о физико-химических свойствах биологических объектов в норме и патологии. Молекулярные механизмы работы цепи переноса электронов в митохондриях, целых клетках и даже в тканях изучают по изменению синей (440 нм) флюоресценции восстановленных пиридиннуклеотидов, возбуждаемой при 365 нм. При изучении структуры нуклеиновых кислот применяют акридиновый оранжевый и другие зонды. При этом определение положения максимума люминесценции в спектре позволяет судить о структуре нуклеиновой кислоты. Так, максимум акридинового оранжевого и двуспиральной нативной ДНК располагается в зеленой области спектра (530 нм), тогда как в одноцепочечной ДНК и РНК он смещается в красную область (640 нм). Микрофлюориметрически с помощью зондов анализируют ДНК непосредственно в клетках. В медицинской технике распространение получили неорганические люминофоры — вещества, способные к фото-, рентгенофлюоресценции и т.д.
Биолюминесценция – видимое свечение организмов, связанное с процессами их жизнедеятельности; являет собой результат биохимической реакции, в которой химическая энергия возбуждает специфическую молекулу, и та излучает свет. Наблюдается у нескольких десятков видов бактерий, низших растений (грибов), у некоторых беспозвоночных животных (от простейших до насекомых включительно), у рыб. Светящиеся организмы иногда размножаются в таком количестве, что вызывают свечение моря. У многих организмов (бактерии, простейшие, ракообразные, грибы и др.) свечение происходит постоянно и непрерывно, если в окружающей среде есть кислород. У других биолюминесценция происходит отдельными вспышками и связана с условиями жизнедеятельности (голод, период размножения и др.). Биологическое значение биолюминесценции различно. Так, у светящихся насекомых вспышки биолюминесценции служат сигналом, позволяющим самцам и самкам находить друг друга; у ряда глубоководных рыб — для освещения и приманки добычи; у каракатицы — для защиты от хищников (путём выбрасывания светящейся жидкости) и др. В некоторых случаях источником биолюминесценции животного являются светящиеся бактерии-симбионты (например, т. н. несамостоятельное свечение ряда рыб).
| <== предыдущая лекция | | | следующая лекция ==> |
| Ионный канал как динамическая структура | | | Основные критерии работоспособности деталей машин |
Дата добавления: 2016-04-11; просмотров: 3633;
