Многие молекулы биологических веществ являются природными или естественными флуорофорами
Многие молекулы биологических веществ являются природными или естественными флуорофорами, т. е. веществами, способными флуоресцировать в определенном диапазоне длин волн при соответствующих условиях возбуждения, например белки. Установлено, что флуоресцировать в белках способны только ароматические аминокислоты. Основным флуоресцирующим компонентом в них является триптофан (макс 348 нм), который обусловливает около 90% всей белковой флуоресценции. Сдвиг максимума в коротковолновую область характерен для малополярного окружения, в длинноволновую – для полярного. Максимумы испускания белков отражают среднюю доступность их триптофановых остатков в водной фазе. Некоторое влияние на положение спектров оказывает комплексообразование с окружающими соединениями.. Флуоресценция белков, не содержащих остатков триптофана, но имеющих в своем составе фенилаланин и тирозин, обусловлена только остатками тирозина, который также является природным флуорофором и имеет максимум спектра флуоресценции при 303–304 нм, а его интенсивность на порядок ниже, чем у триптофана. На положении максимума флуоресценции тирозина, в отличие от триптофана, не сказываются конформационные перестройки макромолекулы. Свечение фенилаланина можно наблюдать только у тех немногих белков, которые не содержат других ароматических аминокислот – триптофана и тирозина (например, преальбумин мышц рыбы, гепатокупреин лошади, рибосомальный белок) . Спектр флуоресценции фенилаланина имеет максимум при 282 нм, и его квантовый выход еще на порядок ниже, чем у тирозина. Но если в состав белка входят все три аминокислоты, то в спектре флуоресценции проявляется только один триптофановый максимум. К природным флуорофорам относятся также нуклеиновые кислоты, коферменты и витамины, продукты окисления и пигменты. Исследование собственной флуоресценции биологических материалов не всегда позволяет получить желаемую информацию об объекте. В таком случае используют искусственные флуорофоры, т. е. специально синтезированные вещества, имеющие специфический спектр флуоресценции либо в свободном состоянии, либо при связывании с тем или иным объектом исследования. Флуоресценция таких веществ (зондов), как правило, обладает высоким квантовым выходом и достаточно большим временем жизни. Метод флуоресцентных зондов основан на регистрации изменений параметров флуоресценции специальных красителей (зондов) в зависимости от физико-химических свойств их микроокружения. В качестве таких зондов потенциально можно использовать любой флуоресцирующий краситель, способный нековалентно (за счет гидрофобного и/или специфического взаимодействия) связываться с биомолекулами и изменять при этом свои параметры флуоресценции, такие как интенсивность, положение спектрального максимума, квантовый выход, поляризация или время жизни флуоресценции. Изменения этих параметров служат источником важной информации о структурном и функциональном состоянии биомолекул. Часто в качестве зондов используют молекулы, которые в воде почти не флюоресцируют, но при связывании с биологическими мембранами, белками и липидами интенсивность их люминесценция возрастает в десятки раз. Методы исследования флуоресценции конкретных веществ обладают высокой чувствительностью, а также удобным временным диапазоном, так как испускание флуоресценции происходит через 10 в -8 с (10 нс) после поглощения света. За это время происходит множество различных молекулярных процессов, которые влияют на спектральные характеристики флуоресцирующего соединения. В настоящее время созданы приборы, позволяющие измерять флуоресценцию 10в-18 с зонда в живой клетке за время около 10 в-5 с, что намного превосходит чувствительность и быстродействие даже таких чувствительных методов, как радиоизотопный и иммуноферментный. Кроме того, исследование флуоресценции позволяет получить информацию о состоянии живых систем, не повреждая их, и не требует большого количества биологического материала.
Зондовая флуоресценция чувствительна к структурно-функциональным изменениям в биологических мембранах, микровязкости ее липидного бислоя, связыванию с белками и другими веществами, структурным перестройкам в белках, изменению мембранного потенциала и концентрации внутри-клеточного кальция и др. Анализируя спектр флуоресценции клеток и мембран, связанных с зондом, можно определить полярность микроокружения флуорофора. Интенсивность и время жизни флуоресценции зонда характеризуют подвижность сольватной оболочки, поляризация флуоресценции – вращательную подвижность, ориентацию и вязкость микроокружения зонда. Тушение флуоресценции зонда посторонними веществами позволяет установить доступность флуорофора для тушителя, его локализацию в белках и мембранах клеток и их проницаемость для тушителей, скорость диффузии. По переносу энергии возбуждения с мембранных белков на флуоресцентный зонд и по степени эксимеризации зонда можно определить расстояние между флуорофорами и вязкость среды, окружающей зонд
Одним из важнейших звеньев в молекулярном механизме действия на организм биологически активных соединений является мембрана. С помощью мембранных зондов можно определить сродство лиганда к мембране, скорость проникновения через нее и его локализацию в клетках и тканях, выяснить связь проницаемости лиганда с его активностью, изучить его действие на структуру и физико-химические свойства мембраны и др. К мембранным зондам относятся такие вещества, как 1-анилинонафталин-8-сульфонат (АНС), пирен, перилен, 4-(n-диметиламиностирил)-N-метилпиридиния (ДСМ), n-толуолсульфонат 4-(n-диметиламиностирил)-1-гексилпиридиния (ДСП) и т. д. Такие зонды позволяют непосредственно наблюдать за процессом проникновения веществ через мембрану, встраиваясь в нее и меняя свою флуоресценцию под действием различных факторов и соединений.
Основным механизмом, позволяющим с помощью зондов получить информацию об исследуемом объекте – мембране, является индуктивно-резонансный перенос энергии, т. е. энергии возбужденного состояния от донора к акцептору, который определяется в основном диполь-дипольными взаимодействиями между ними. Такой обмен энергии может осуществляться либо между различными молекулами, либо между частями одной и той же молекулы. Скорость переноса энергии зависит от степени перекрывания спектра испускания донора со спектром поглощения акцептора, относительной ориентации дипольных моментов переходов и расстояния между молекулами. Данный перенос энергии является безызлучательным и содержит богатую информацию, касающуюся строения молекул донорно-акцепторных пар. Любые явления, влияющие на расстояние между донором и акцептором, будут воздействовать на скорость переноса энергии, а следовательно, позволят их количественно охарактеризовать. Так, на основании изучения индуктивно-резонансного переноса энергии между двумя хромофорами, локализованными в разных участках эритроцитарной мембраны, было сделано заключение, что под действием радиации в ней уменьшается эффективная толщина гидрофобной области. В дальнейшем оно подтверждено исследованием параметров флуоресценции зондов – пирена и 1,6-дифенил-1,3,5-гексатриена (ДФГТ) в облученных мембранах эритроцитов крыс. После облучения происходило уменьшение флуоресценции зондов и времени жизни возбужденного состояния по сравнению с контрольной группой вследствие динамического тушения водой. При исследовании физико-химического состояния мембран жировой ткани и печени крыс в отдаленные сроки после гамма-облучения и структурных изменений мембран было обнаружено следующее. За счет переноса энергии с мембранных триптофанилов на пирен при длине волны возбуждения 286 нм наблюдали флуоресценцию зонда, локализованного в прибелковой части липидного бислоя (аннулярный липид), при возбуждении с длиной волны 330 нм – пирена, локализованного как вблизи белка, так и в липидном слое (общий липид). Рассчитанный коэффициент эксимеризации пирена позволил установить структурную модификацию плазматических мембран жировой ткани и печени крыс после однократного гамма-облучения в дозе 1 Гр, выражающуюся в увеличении микровязкости липидной фазы мембран как в прибелковой области, так и в области суммарного липида
С помощью механизма индуктивно-резонансного переноса энергии было изучено структурное и физико-химическое состояние мембран эритроцитов у пациентов с хроническими заболеваниями печени. Выявлено уменьшение эффективности переноса энергии с мембранных триптофанилов на пирен у этих больных по сравнению с контрольной группой, что выражалось в снижении количества белка, доступного тушению зондом. Уменьшение параметра эксимеризации пирена свидетельствовало об увеличении микровязкости липидного бислоя мембран и уменьшении его текучести. Полученные данные позволили сделать вывод о том, что при хронических заболеваниях печени происходят значительные структурные перестройки в белках мембран эритроцитов.
Мембранные зонды можно использовать при диагностике таких заболеваний, как инфаркт миокарда, нестабильная стенокардия, нейроциркуляторная дистония по гипертензивному типу, хронический алкоголизм.
В основе метода флуоресцентного определения мембраносвязанного кальция лежит способность антибиотика хлортетрациклина, локализованного в мембране, образовывать комплекс с ионом кальция, что приводит к увеличению квантового выхода флуоресценции зонда. Его свечение регистрируют с одного и того же участка клетки в течение всего времени эксперимента с помощью люминесцентного микроскопа. Возбуждение флуоресценции ХТЦ вызывают с помощью галогенной лампы накаливания, выделяя полосу за счет комбинации фильтров. Регистрацию свечения проводят с помощью фотометрической насадки, выделяя полосу с помощью интерференционных светофильтров при длине волны максимального пропускания светового пучка 490 и 550 нм.
При регистрации внутриклеточного рН в качестве зонда используют дигидроксиацетонфосфат (ДГАФ) в конечной концентрации 10-5 моль. После 20 мин инкубации (время, необходимое для накопления в объекте достаточного для флуориметрии количества флуоресценции) клетки тщательно отмывают от экстраклеточного ФДА. Для обеспечения постоянного рН экстраклеточной среды при инкубации клеток добавляют 50 ммоль HEPES, доводя рН раствора до 6,2 - 8,5. Спектры флуоресценции препаратов регистрируют с помощью инвертированного микроспектрофлуориметра: возбуждение флуоресценции препаратов осуществляют обычно с помощью галогенной лампы накаливания и комбинации стеклянных светофильтров. Значение внутриклеточного рН определяют по величине отношения интенсивностей флуоресценции окрашенного препарата при длинах волн 516 и 570 нм, сопоставляя его со значениями соответствующей калибровочной кривой, представляющей собой зависимость величины этого отношения от значений рН буферных растворов флуоресцеина.
В лабораторной и научно-исследовательской практике для регистрации спектров флуоресценции применяют спектрофлуориметры. Основными их узлами являются источник возбуждающего света, монохроматоры для выделения как возбуждающего, так и испускаемого света, фотоумножители и регистрирующее сигнал электронное устройство. Рис1
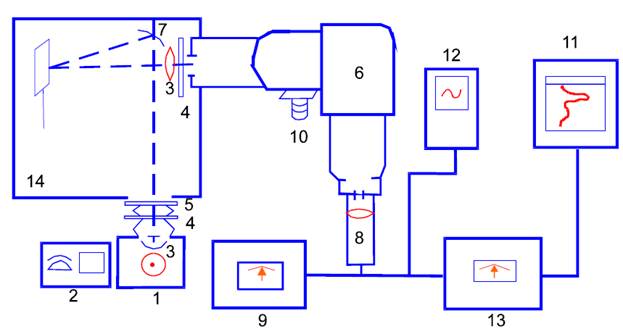
1. Источник возбуждающего света. 2. Автотрансформатор. 3. Линза. 4. Светофильтр. 5. Фотозатвор. 6. Монохроматор. 7. Зеркало. 8. Фотоумножитель.9. Высоковольтный источник питания. 10. Мотор барабана длин волн. 11. Самопишущий потенциометр.
12. Осциллограф. 13. Усилитель. 14. Кюветная камера.
Диагностические возможности существенно расширяются за счет применения флюоресцентных зондов. При введении в организм некоторых гидрофобных порфиринов (гематопорфирина и его производных) эти соединения избирательно накапливаются в опухолевой ткани. Под действием возбуждающего порфирины света наблюдается красная флюоресценция опухолей. Это явление используется для визуального распознавания опухолей кожи, а с помощью эндоскопической техники — опухолей трахеи, бронхов, желудочно-кишечного тракта и др. Свойством накапливаться в опухолях обладает также тетрациклин, флюоресценция которого в опухоли в несколько раз выше, чем в окружающих ее тканях. Эту особенность используют в ряде случаев для того, чтобы отличить опухолевое поражение желудка от воспалительного или язвенного, при которых подобного роста флюоресценции не наблюдается. При этом в иммунном флуоресцентном анализе к антителу непосредственно присоединяют флуоресцирующие в-ва, флуоресцирующие красители (чувствительность метода 10в-14 моль/л), а в иммуноферментном анализе к антителу присоединяют фермент и в результате ферментативной р-ции, сопровождаемой биолюминесценцией, определяют ферментативную активность (чувствительность метода 10в-11 моль/л).
Если в локтевую вену человека ввести несколько миллилитров раствора флюоресцеина, то через несколько секунд ярко-зеленую флюоресценцию можно наблюдать в тканях глаза, слизистой оболочке рта и на губах. Данный метод можно использовать, для определения скорости кровотока. Так, было показано, что зонд ДСМ ((4-N-диметиламиностирил)-
1-метилпиридиний-N-толуолсульфонат) связывается преимущественно с головками и шейками
сперматозоидов собак и в меньшей степени с хвостами. При этом наблюдается многоцветная флуоресценция зонда: из области головок — яркая оранжево-желтая, из шеек — зеленая, слабо-зеленым цветом светятся хвосты. Благодаря наличию гибкого звена,
соединяющего метилпиридиновое кольцо с анилиновым, молекула обладает свойствами полиенов и легко претерпевает конформационную изомеризацию в полярных средах, ведущую к безызлучательной конверсии S1*-> S0 и сопровождающуюся снижением квантового выхода
флуоресценции. В вязких средах, а также при связывании с биомембранами или белками, напротив, флуоресценция ДСМ может возрастать в 10 раз и более. ДСМ известен как потенциалзависимый зонд, используемый для определения поверхностного потенциала клеток. В то же время в различных клетках он может проявлять как «красную» (610 нм), так и «зеленую» (560 нм) флуоресценцию. При связывании с ДНК видна лишь красная полоска, в бактериях, покрытых оболочкой, на поверхности которой расположен слой отрицательно заряженного липополисахарида, — в основном зеленая, а в других мембранах или белках могут присутствовать
обе. Флуоресцентный зонд класса флавонолов ФМЕ может иметь два полосы в спектре флуоресценции,вследствие того что в возбужденном состоянии он образует две изомерные формы — нормальную (N*) и таутомерную (T*). Каждая из этих форм является флуоресцирующей, вследствие чего в спектре ФМЕ наблюдаются две полосы — зелено-голубая (форма N*) и желто-оранжевая (форма T*). Положение и интенсивность этих полос зависят от полярности, протон-
донорной способности и вязкости среды. ФМЕ выгодно отличается от других классов флуоресцентных зондов тем, что позволяет одновременно определять такие физические параметры окружения, как локальная диэлектрическая проницаемость среды и коэффициент
рефракции, а также дает возможность отличать полярность окружения, вызванную образованием
водородных связей, от эффекта неспецифических межмолекулярных взаимодействий.
Регистрация люминесценции позволяет получать важную информацию о физико-химических свойствах биологических объектов в норме и патологии. Молекулярные механизмы работы цепи переноса электронов в митохондриях, целых клетках и даже в тканях изучают по изменению синей (440 нм) флюоресценции восстановленных пиридиннуклеотидов, возбуждаемой при 365 нм. При изучении структуры нуклеиновых кислот применяют акридиновый оранжевый и другие зонды. При этом определение положения максимума люминесценции в спектре позволяет судить о структуре нуклеиновой кислоты. Так, максимум люминесценции акридинового оранжевого и двуспиральной нативной ДНК располагается в зеленой области спектра (530 нм), тогда как в одноцепочечной ДНК и РНК он смещается в красную область (640 нм). Микрофлюориметрически с помощью зондов анализируют ДНК непосредственно в клетках. В медицинской технике распространение получили неорганические люминофоры — вещества, способные к фото-, рентгенофлюоресценции и т.д.
Флуоресцентные липидные зонды содержат группировку, обусловливающую флуоресценцию соед. на рис2.
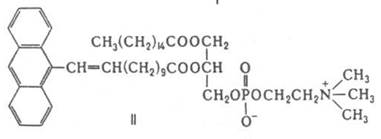
Параметры спектров таких липидных зондов (интенсивность испускания, поляризация и др.) позволяют получать данные о подвижности и упорядоченности отдельных молекул и надмолекулярных структур (напр., участков биол. мембран), о взаимод. молекул и св-вах окружения (напр., полярности) липидных зондов в изучаемой системе. Флуоресцентные липидные зонды также применяют для изучения распределения и метаболизма липидов в клетках и тканях.
В методе FISH используются флуоресцирующие молекулы – DAPI синий - для прижизненной окраски генов или хромосом. Метод используется для картирования генов и идентификации хромосомных аберраций. Методика начинается с приготовления коротких последовательностей ДНК, называемых зондами, которые являются комплементарными по отношению к последовательностям ДНК, представляющим объект изучения. Зонды гибридизуются с комплементарными участками ДНК и благодаря тому, что они помечены флуоресцентной меткой, позволяют видеть локализацию интересующих генов в составе ДНК или хромосом.
Хорошо флуоресцируют полиненасыщенные, конденсированные, а также, разумеется, ароматические и полиароматические соединения, в особенности гетероатомные или с электрон-донорными заместителями в кольце. Отличной флуоресценцией обладают специальные флуоресцентные органические и неорганические материалы, находящие свое применение при изготовлении дисплеев, мониторов, фотодиодов и лазеров.
К примеру, распространенной флуоресцентной меткой является дансилхлорид, который может неселективно связываться с любыми гидроксильными и аминогруппами (исследуего соединения, к примеру, белка). Примером наиболее простого гидрофобного флуоресцентного зонда, применяемого для изучения липидных слоев, является дифенилгексатриен (ДФГ).
В лаборатории разработаны три метода с использованием флуоресцентных зондов, которые уже применяются в клинике или находятся в стадии клинических испытаний. Первый предназначен для определения объема гидрофобных липидов в плазме крови как факторов риска развития атеросклероза. Созданы специальные флуориметры и наборы реактивов, рекомендованные Минздравом к клиническому применению. Уже проведено более 1 млн анализов. Второй метод чувствителен к свойствам связывающих центров альбумина в плазме крови. Показано, что конформация центров может изменяться при целом ряде заболеваний. Выпущены наборы реактивов, и метод проходит испытания в десятках клиник. Третий метод реагирует на трансмембранные поля клеток крови, которые чрезвычайно чувствительны к аллергическим заболеваниям и в ряде других случаев.
| <== предыдущая лекция | | | следующая лекция ==> |
| Возраст живого организма (или стадия онтогенетического развития) | | | Ионные токи в модели Ходжкина-Хаксли. Воротные токи. Флуктуации напряжения и проводимости в модельных и биологических мембранах |
Дата добавления: 2016-04-11; просмотров: 2911;
