Физиология скелетных мышц
Физическая нагрузка реализуется в результате согласованных действий скелетной мускулатуры. Рассмотрим основные характеристики их структуры и функции.
Взаимодействие человека с внешней средой не может осуществляться без сокращений его мышц. Производимые при этом движения необходимы как для выполнения простейших манипуляций, так и для выражения самых тонких мыслей и чувств - посредством речи, письма, с помощью мимики или жестов. Масса мышц намного больше, чем других органов; они составляют 40-50% массы тела. Мышцы - это «машины», преобразующие химическую энергию непосредственно в механическую (работу) и в теплоту. Деятельность их, в частности механизм укорочения и генерирования силы, сейчас можно достаточно детально объяснить на молекулярном уровне с использованием физических и химических законов.
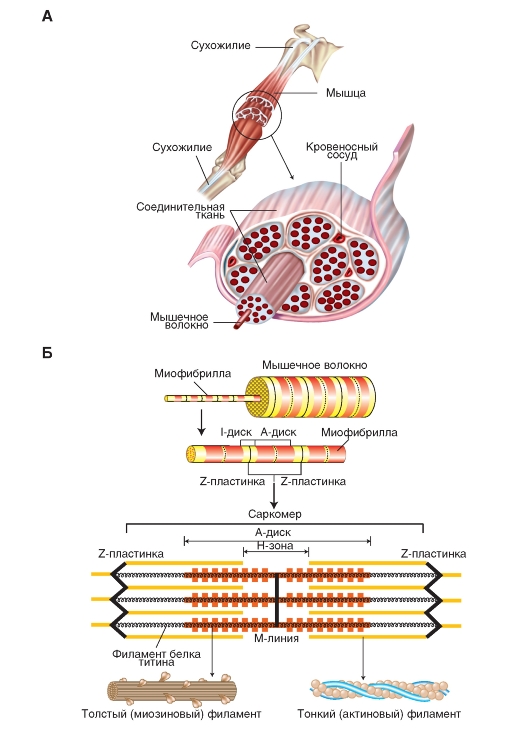
Рис 1. Структура скелетных мышц:организация цилиндрических волокон в скелетной мышце, прикрепленной к костям сухожилиями.
Понятие скелетная,или поперечно-полосатая мышцаотносится к группе мышечных волокон, связанных соединительной тканью (рис. 1). Обычно мышцы прикреплены к костям пучками коллагеновых волокон - сухожилиями,находящимися на обоих концах мышцы. В некоторых мышцах одиночные волокна имеют такую же протяженность, как и вся мышца, но в большинстве случаев волокна короче и часто располагаются под углом к продольной оси мышцы. Есть очень длинные сухожилия, они прикреплены к кости, удаленной от конца мышцы. Например, некоторые мышцы, осуществляющие движения пальцев рук, находятся в предплечье; шевеля пальцами, мы чувствуем, как двигаются мышцы кисти. Эти мышцы соединены с пальцами посредством длинных сухожилий
Что такое скелетная мышца?
Один грамм ткани скелетной мышцы содержит примерно 100 мг «сократительных белков» - актина (молекулярная масса 42000) и миозина (молекулярная масса 500 000).
Скелетная мышца, например, бицепс, по виду кажется единым образованием, но на самом деле состоит из тканей нескольких типов. В состав каждой мышцы входят длинные тонкие цилиндрические мышечные волокна (клетки), вытянутые по всей ее длине; поэтому они могут быть очень длинными. Каждая многоядерная мышечная клетка (волокно) окружена параллельными мышечными волокнами, с которыми связана слоем соединительной ткани под названием эндомизий. Эти волокна собраны в пучки, скрепленные слоем соединительной ткани, под названием перимизий. Такая упакованная группа, или связка, волокон называется мышечным пучком. Группы пучков с прилегающими к ним сосудами и нервами связаны друг с другом с помощью еще одного слоя соединительной ткани под названием эпимизий. Собранные вместе и окруженные эпимизием пучки, которые тянутся по всей длине скелетной мышцы, покрыты сверху слоем соединительной ткани, называемым фасцией.
Какова функция фасции в скелетной мышце?
Фасция — это упругая, плотная и прочная соединительнотканная оболочка, которая покрывает мышцу целиком и, выходя за ее пределы, образует фиброзное сухожилие. Фасция образована посредством слияния всех трех внутренних слоев соединительной ткани скелетной мышцы. Фасция отделяет мышцы друг от друга, уменьшает трение при движении и формирует сухожилие, с помощью которого мышца прикрепляется к костному скелету. Этому компоненту мышц обычно не уделяется должного внимания. Тем не менее, многие специалисты полагают, что для свободного неограниченного движения мышцы, а, следовательно, и сустава совершенно необходимо свободное движение фасции.
.

Рис. 2. Структура скелетных мышц: структурная организация филаментов в волокне скелетной мышцы, создающая картину поперечных полос.
Почему скелетная мышца называется поперечно-полосатой?
При изучении с помощью светового микроскопа, основной характеристикой волокон скелетной мышцы оказалось чередование светлых и темных полос, поперечных по отношению к длинной оси волокна. Поэтому скелетные мышцы были названы поперечно-полосатыми.
Поперечная исчерченность волокон скелетной мышцы обусловлена особым распределением в их цитоплазме многочисленных толстых и тонких «нитей» (филаментов), объединяющихся в цилиндрические пучки диаметром 1-2 мкм - миофибриллы(рис. 2). Мышечное волокно практически заполнено миофибриллами, они тянутся по всей его длине и на обоих его концах соединены с сухожилиями. Миофибриллы состоят из сократительных филаментов (белков). Основных сократительных микро-филаментов два — миозин и актин. Структурное расположение этих белков придает скелетной мышце вид перемежающихся светлых и темных полос. Каждая темная полоса (полоса, или диск, А) соответствует участку, где актиновые и миозиновые белки перекрываются, тогда как более светлая полоса — участку, где их перекрытия нет (полоса, или диск, I). Перегородки, называемые Z-пластинками, разделяют их на несколько компартментов-саркомеров - длиной примерно по 2,5 мкм.
Что является структурной единицей мышечной ткани скелетной мышцы?
Структурной единицей мышечной ткани скелетной мышцы являются мышечные клетки, которые существенно отличаются от других мышечных тканей, прежде всего от гладких мышц
Гладкое мышечное волокно - это веретеновидная клетка диаметром от 2 до 10 мкм. В отличие от многоядерных волокон скелетных мышц, которые после завершения дифференцировки уже не могут делиться, гладкие мышечные волокна обладают единственным ядром и способны к делению на протяжении всей жизни организма. Деление начинается в ответ на разнообразные паракринные сигналы, часто - на повреждение ткани.
Поперечно-полосатые мышцы скелета состоят из множества функциональных единиц — мышечных волокон, которые расположены в общем соединительнотканном футляре. Каждое волокно скелетной мышцы — это тонкое (диаметром 0,01—0,1 мм), вытянутое на 2—3 см, многоядерное образование — симпласт—результат слияния многих клеток. Ядра в волокне расположены около его поверхности. Пучки мышечных волокон окружены коллагеновыми волокнами и соединительной тканью; между волокнами также находится коллаген. На конце мышц коллаген вместе с соединительной тканью образует сухожилия, которые служат для прикрепления мышц к разным частям скелета. Каждое волокно окружено мембраной — сарколеммой, которая по своему строению сходна с плазматической мембраной.
Основной особенностью мышечного волокна является наличие в его цитоплазме — саркоплазме большого количества тонких нитей — миофибрилл, расположенных вдоль оси волокна. Миофибриллы состоят из чередующихся светлых и темных участков — дисков, что придает мышечному волокну поперечную исчерченность (полосатость).
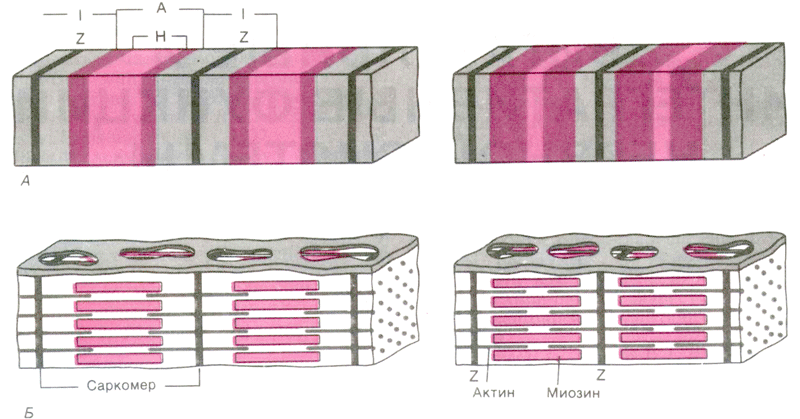
Рис 3. Организация миозиновых и актиновых нитей в расслабленном и сократившемся саркомере.
Что такое саркомер?
Это минимальная сократительная единица скелетной мышцы.
Рассмотрим более детальноструктуру саркомеров, которая схематически показана на рис 3. С помощью светового микроскопа в них можно видеть регулярно чередующиеся поперечные светлые и темные полосы. Согласно теории Хаксли и Хансон, такая поперечная полосатость миофибрилл обусловлена особым взаиморасположением актиновых и миозиновых филаментов. Середину каждого саркомера занимают несколько тысяч «толстых» нитей миозина диаметром примерно по 10 нм. На обоих концах саркомера находятся около 2000 «тонких» (толщиной по 5 нм) нитей актина, прикрепленных к Z-пластинкам наподобие щетинок в щетке.
Толстые филаменты сосредоточены в средней части каждого саркомера, где они лежат параллельно друг другу; эта область выглядит как широкая темная (анизотропная) полоса, называемая А-полосой.В обеих половинах саркомера находится по набору тонких филаментов. Один конец каждого из них прикреплен к так называемой Z-пластинке(или Z-линии, или Z-полосе) - сети из переплетающихся белковых молекул, - а другой конец перекрывается с толстыми филаментами. Саркомер ограничен двумя последовательно расположенными Z-полосами. Таким образом, тонкие филаменты двух соседних саркомеров закреплены на двух сторонах каждой Z-полосы.
| Светлая (изотропная) полоса - так называемая I-полоса- расположена между краями А-полос двух соседних саркомеров и состоит из тех участков тонких филаментов, которые не перекрываются с толстыми филаментами. Z-полоса делит I-полосу пополам. |
В пределах А-полосы каждого саркомера различают еще две полоски. В центре А-полосы видна узкая светлая полоска - Н-зона.Она соответствует промежутку между противостоящими друг другу концами двух наборов тонких филаментов каждого саркомера, т.е. включает только центральные части толстых филаментов. Посередине Н-зоны находится совсем тонкая темная М-линия.Это сеть белков, соединяющих центральные части толстых филаментов. Кроме того, от Z-полосы к М-линии идут филаменты белка титина, связанные одновременно с белками М-линии и с толстыми филаментами. М-линия и титиновые филаменты поддерживают упорядоченную организацию толстых филаментов в середине каждого саркомера. Таким образом, толстые и тонкие филаменты не являются свободными, незакрепленными внутриклеточными структурами.
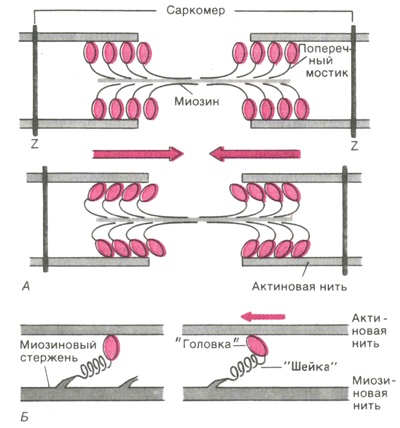
Рис 4. Функция поперечных мостиков. А. Модель механизма сокращения
Обсудим собственно механизм мышечного сокращения
Каким образом взаимодействуют актин и миозин?
Активные участки молекулы актина, способные связывать глобулярные головки миозина , располагаются на ней на некотором расстоянии друг от друга. Когда эти активные участки открыты, миозиновая головка самопроизвольно связывается с актиновым филаментом и образует поперечный мостик. При снабжении миозиновой головки достаточным количеством энергии глобулярная головка подтягивает актин по направлению к центру саркомера, что часто называют храповым движением. Это движение укорачивает саркомер.
Работа поперечных мостиков (Рис. 4). Во время сокращения каждая миозиновая головка может связывать миозиновую нить с соседними актиновыми. Движение головок создает объединенное усилие, как бы «гребок», продвигающий актиновые нити к середине саркомера. Сама биполярная организация молекул миозина обеспечивает противоположную направленность скольжения актиновых нитей в левой и правой половинах саркомера. В результате однократного движения поперечных мостиков вдоль актиновой нити саркомер укорачивается только на 2 х 10 нм, т. е. примерно на 1% своей длины. За счет ритмичных отделений и повторных прикреплений миозиновых головок актиновая нить может подтягиваться к середине саркомера, подобно тому, как группа людей тянет длинную веревку, перебирая ее руками. Следовательно, когда принцип «вытягивания веревки» реализуется во множестве последовательных саркомеров, повторяющиеся молекулярные движения поперечных мостиков приводят к макроскопическому движению. При расслаблении мышцы миозиновые головки отделяются от актиновых нитей. Поскольку актиновые и миозиновые нити могут легко скользить друг относительно друга, сопротивление расслабленных мышц растяжению очень низкое. Их можно снова растянуть до исходной длины, приложив совсем небольшое усилие. Следовательно, удлинение мышцы во время расслабления носит пассивный характер.

Рис 5. Функция поперечных мостиков. Б. Модель механизма генерирования силы поперечными мостиками: слева до, справа - после «гребка
Генерирование мышечной силы. Благодаря упругости поперечных мостиков саркомер может развивать силу даже без скольжения нитей относительно друг друга, т. е. в строго изометрических экспериментальных условиях. Рис.5.Б иллюстрирует такой процесс генерирования изометрической силы. Сначала головка миозиновой молекулы прикрепляется к актиновой нити под прямым углом. Затем она наклоняется под углом примерно 45°, возможно, благодаря притяжению между соседними точками прикрепления на ней и на актиновой нити. При этом головка действует как миниатюрный рычаг, приводя внутреннюю упругую структуру поперечного мостика (видимо, «шейки» между головкой и миозиновой нитью) в напряженное состояние. Возникающее в результате упругое растяжение достигает лишь около 10 нм. Упругое натяжение, создаваемое индивидуальным поперечным мостиком, так слабо, что для развития мышечной силы, равной 1 мН, нужно объединить усилия, по крайней мере, миллиарда таких соединенных параллельно мостиков. Они будут тянуть соседние актиновые нити, как команда игроков тянет канат. Даже при изометрическом сокращении поперечные мостики не находятся в непрерывно напряженном состоянии (это наблюдается только при трупном окоченении). На самом деле каждая миозиновая головка уже через сотые или десятые доли секунды отделяется от актиновой нити; однако через такое же короткое время следует новое прикрепление к ней. Несмотря на ритмичное чередование прикреплений и отделений с частотой порядка 5 - 50 Гц, сила, развиваемая мышцей в физиологических условиях, остается неизменной (исключение - летательные мышцы насекомых), так как статистически в каждый момент времени в прикрепленном, обусловливающем напряжение, состоянии находится одно и то же количество мостиков.
Что такое цикл поперечного мостика?
Цикл поперечного мостика — это термин, описывающий взаимодействие глобулярной головки миозина с активным участком молекулы актина. Формированию поперечного мостика способствуют два фактора: повышение внутриклеточной концентрации ионов кальция и присутствие аденозинтрифосфата (АТФ). Один цикл поперечного мостика состоит из:
активации миозиновой головки;
обнажения активного участка молекулы актина в присутствии кальция;
самопроизвольного формирования поперечного мостика;
поворота глобулярной головки, сопровождающегося продвижением актиновой нити и укорочением саркомера;
отцепления поперечного мостика.
Цикл после завершения может повторяться или останавливаться. Поворот миозиновой головки называется также рабочим ходом.
Чем предотвращается спонтанное взаимодействие миозина и актина после отцепления поперечного мостика? Каков механизм циклического формированию поперечного мостика – повторяющегося взаимодействия глобулярной головки миозина с активным участком молекулы актина?
Для понимания всего этого необходимо внимательнее рассмотреть строение миозина и, особенно, актина.
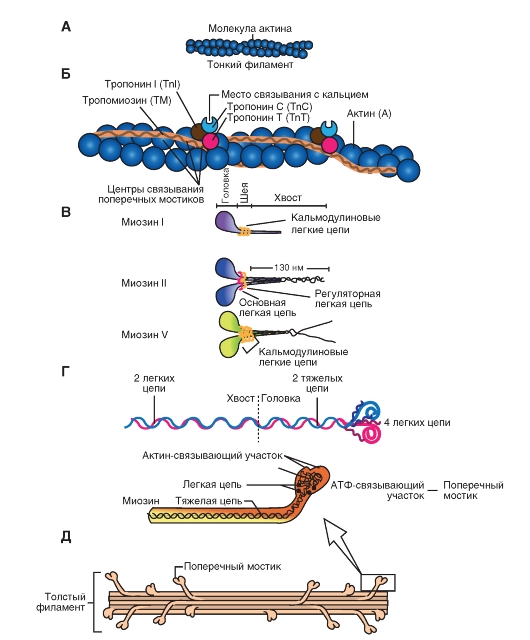
Рис. 6. Строение миозина
Миозин
Это единое название большой семьи протеинов, имеющих определенные отличия в клетках разных тканей. Миозин присутствует у всех эукариотов. Около 60 лет назад было известно два типа миозина, которые сейчас называют миозин I и миозин II. Миозин II был первым из числа открытых миозинов, и именно он принимает участие в мышечном сокращении. Позднее были открыты миозин I и миозин V (рис. 6 В). В последнее время показано, что миозин II участвует в мышечном сокращении, тогда как миозин I и миозин V вовлечены в работу подмембранного (кортикального) цитоскелета. В настоящее время идентифицировано более 10 классов миозина. На рисунке 6 Г показано два варианта схемы строения миозина, который состоит из головки, шейки и хвоста. Молекула миозина состоит из двух больших полипептидов (тяжелых цепей) и четырех меньших (легких цепей). Эти полипептиды составляют молекулу с двумя глобулярными «головками», которые содержат оба вида цепей, и длинным стержнем («хвостом») из двух переплетенных тяжелых цепей. Хвост каждой молекулы миозина располагается вдоль оси толстого филамента, а две глобулярные головки выступают по бокам.На каждой глобулярной головке находятся по два участка связывания: для актина и для АТФ. Участки связывания АТФ обладают также свойствами фермента АТФазы, гидролизующей связанную молекулу АТФ.

Рис 7. Строение актина
Молекула актина
Это глобулярный белок, состоящий из одного полипептида, который полимеризуется с другими молекулами актина и образует две цепи, обвивающие друг друга (рис. 7 А). Такая двойная спираль представляет собой остов тонкого филамента. На каждой молекуле актина есть участок связывания миозина. В покоящемся мышечном волокне взаимодействие между актином и миозином предотвращают два белка - тропонини тропомиозин(рис. 7 Б).
| Тропомиозин - стержневидная молекула из двух полипептидов, обвивающихся друг около друга; молекула соответствует в длину примерно семи мономерам актина. Цепи из молекул тропомиозина, уложенные конец в конец, располагаются вдоль всего тонкого филамента. Молекулы тропомиозина частично прикрывают участки связывания каждой молекулы актина,мешая контакту миозина с актином. В таком блокирующем положении молекула тропомиозина удерживается тропонином. |
Тропонин - гетеротримерный белок. Он состоит из тропонина Т (отвечает за связывание с одиночной молекулой тропомиозина), тропонина С (связывает ион Са2+) и тропонина I (связывает актин и ингибирует сокращение). Каждая молекула тропомиозина связана с одной гетеротримерной молекулой тропонина, которая регулирует доступ к участкам связывания миозина на семи мономерах актина, прилегающих к молекуле тропомиозина.
Чем предотвращается спонтанное взаимодействие миозина и актина?
В желобках двойной спирали актина располагаются два дополнительных регуляторных белка, которые предотвращают самопроизвольное взаимодействие актина и миозина. Эти белки, тропонин и тропомиозин, играют важную роль в процессе сокращения скелетной мышцы. Функция тропомиозина заключается в том, что в покое он закрывает (защищает) активные участки актинового филамента. Тропонин имеет три связывающих участка: один служит для связывания ионов кальция (тропонин С), другой прочно прикреплен к молекуле тропомиозина (тропонин Т), третий связан с актином (тропонин I). В покое эти регуляторные белки закрывают связывающие участки на молекуле актина и препятствуют формированию поперечных мостиков. Все эти микроструктурные компоненты вместе с митохондриями и другими органеллами клетки окружены клеточной мембраной, называемой сарколеммой.
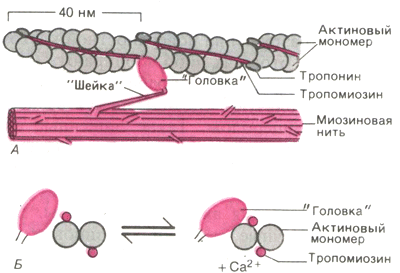
Рис. 8. Действие Са2+ во время активации миофибриллы.
А.Актиновая и миозиновая нити на продольном сечении волокна. Б. Они же на его поперечном сечении.
Исследования с помощью рентгеноструктурного анализа (малоугловое рентгеновское рассеяние) показали, что в отсутствие Са2+ , т. е. при расслабленном состоянии миофибрилл, длинные молекулы тропомиозина располагаются так, что блокируют прикрепление поперечных миозиновых головок к актиновым нитям. И напротив, когда Са2+ связывается с тропонином, тропомиозин попадает в желобок между двумя мономерами актина, обнажая участки прикрепления для поперечных мостиков (Рис. 8).
Если активные участки закрыты, то каким образом взаимодействуют актин и миозин?
Когда внутри клетки повышается концентрация ионов кальция, они связываются с тропонином С. Это приводит к изменениям конформации тропонина. В результате изменяется также трехмерная структура тропомиозина и обнажается активный участок молекулы актина. Сразу после этого головка миозина самопроизвольно связывается с активным участком актинового филамента, образуя поперечный мостик, который начинает двигаться и способствует укорочению саркомера. Наличие или отсутствие в клетке кальция частично регулируется сарколеммой (специализированной клеточной мембраной скелетной мышцы).
Какова функция кальция в скелетных мышцах?
Кальций обеспечивает открытие участков актиновой нити, связывающих миозин. Ионы кальция внутри клетки хранятся в СР( саркоплазматическом ретикуломе) и высобождаются после деполяризующей стимуляции. После высвобождения кальций диффундирует и связывается с белком — тропонином С. В результате конформация белка изменяется, он тянет молекулу тропомиозина и обнажает активные участки молекулы актина. Активные участки остаются открытыми все время, пока продолжается связывание кальция с тропонином С.
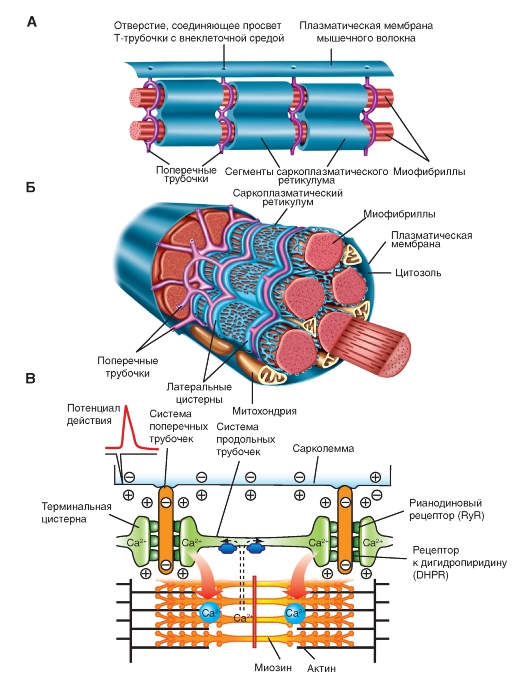
Рис. 9. Схема организации саркоплазматического ретикулума, поперечных трубочек и миофибрилл.
Хранение и высвобождение ионов кальция. Расслабленная мышца содержит более 1 мкмоль Са2+ на 1 г сырой массы. Если бы соли кальция не были изолированы в особых внутриклеточных хранилищах, обогащенные его ионами мышечные волокна находились бы в состоянии непрерывного сокращения.
Источником поступления Са2+ в цитоплазму служит саркоплазматический ретикулуммышечного волокна.
Саркоплазматический ретикулуммышц гомологичен эндоплазматическому ретикулуму других клеток. Он располагается вокруг каждой миофибриллы наподобие «рваного рукава», сегментами которого окружены А- и I-полосы (Рис. 9). Концевые части каждого сегмента расширяются в виде так называемых латеральных мешков(терминальных цистерн), соединенных друг с другом серией более тонких трубок. В латеральных мешках депонируется Са2+, высвобождающийся после возбуждения плазматической мембраны (рис. 10).

Рис. 10. Схема анатомической структуры поперечных трубочек и саркоплазматического ретикулума в индивидуальном волокне скелетной мышцы
Что такое поперечные трубочки (Т-трубочки)?
Инвагинации на поверхности сарколеммы, расположенные на некотором расстоянии друг от друга. Благодаря Т-трубочкам внеклеточная жидкость может тесно контактировать с внутренними микроструктурами клетки. Т-трубочки представляют собой продолжение сарколеммы и также способны передавать потенциал действия на внутреннюю поверхность клетки. С Т-трубочками тесно взаимодействует саркоплазматический ретикулум (СР).
Что такое саркоплазматический ретикулум?
Специализированный эндоплазматический ретикулум, который состоит из везикул, ориентированных вдоль сократительных волокон скелетной мышцы. Эти везикулы осуществляют хранение, высвобождение во внутриклеточную жидкость и обратный захват ионов кальция. Специализированные расширенные участки СР называются концевыми цистернами. Концевые цистерны находятся в непосредственной близости от Т-трубочки и вместе с СР составляют структуру под названием триада. Особенности строения сарколеммы и триад играют важную роль в обеспечении саркомера ионами кальция, необходимыми для цикла поперечных мостиков.

Рис. 11. Роль саркоплазматического ретикулума в механизме сокращения скелетной мышцы
Возникнув в плазматической мембране (рис. 11), потенциал действия быстро распространяется по поверхности волокна и по мембране Т-трубочек вглубь клетки. Достигнув области Т-трубочек, прилегающей к латеральным мешкам, потенциал действия активирует потенциалзависимые «воротные» белки мембраны Т-трубочек, физически или химически сопряженные с кальциевыми каналами мембраны латеральных мешков. Таким образом, деполяризация мембраны Т-трубочек, обусловленная потенциалом действия, приводит к открыванию кальциевых каналов мембраны латеральных мешков, содержащих Са2+ в высокой концентрации, и ионы Са2+ выходят в цитоплазму. Повышение цитоплазматического уровня Са2+ обычно бывает достаточным для активации всех поперечных мостиков мышечного волокна.
Процесс сокращения продолжается, пока ионы Са2+ связаны с тропонином, т.е. до тех пор, пока их концентрация в цитоплазме не вернется к низкому исходному значению. Мембрана саркоплазматического ретикулума содержит Са-АТФазу - интегральный белок, осуществляющий активный транспорт Са2+ из цитоплазмы обратно в полость саркоплазматического ретикулума. Как только что говорилось, Са2+ высвобождается из ретикулума в результате распространения потенциала действия по Т-трубочкам; для возвращения Са2+ в ретикулум нужно гораздо больше времени, чем для его выхода. Именно поэтому, повышенная концентрация Са2+ в цитоплазме сохраняется в течение некоторого времени, и сокращение мышечного волокна продолжается после завершения потенциала действия.
Подведем итог. Сокращение обусловлено высвобождением ионов Са2+, хранящихся в саркоплазматическом ретикулуме. Когда Са2+ поступает обратно в ретикулум, сокращение заканчивается и начинается расслабление.
Каковы особенности сарколеммы?
Электрический заряд на сарколемме, как и на других селективно проницаемых и возбудимых мембранах, образуется вследствие неодинакового распределения ионов. Проницаемость сарколеммы изменяется при стимуляции ацетилхолиновых рецепторов, расположенных в нервно-мышечном соединении. После достаточной стимуляции сарколемма может проводить деполяризующий сигнал (потенциал действия) по всей своей длине, а также в уникальную проводящую систему Т-трубочек.
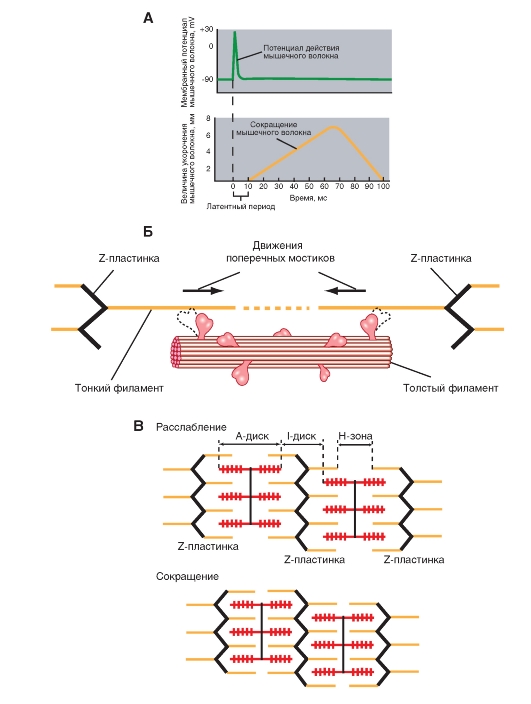
Рис. 12. Феномен электромеханического сопряжения
Дата добавления: 2016-04-02; просмотров: 2128;
