Ионный транспорт в каналах
Основные представления о структуре и функциях мембран, унитарная модель. Модельные (искусственные) мембраны и способы их получения. Монослои, мицеллы, бислойные структуры, фосфолипидные везикулы. Подвижность липидной мембраны, способность самозамыкаться, механические свойства, поры. Латеральная диффузия и трансбислойное движение молекул.
Биологические мембраны – надмолекулярные структуры, протяженность которых в двух измерениях существенно больше их толщины.
Функции:
- через мембраны проходит пассивный транспорт ионов и биомолекул.
- активный перенос ионов против градиента электрохимического потенциала
- биоэнергетика (окислительное фосфорилирование, фотосинтез)
- биосинтез белков, ферментов и др. биомолекул
- рецепция сигналов и межклеточный обмен сигналами
Согласно жидкостно-мозаичной модели структуры мембраны, предложенной Сингером, биологическая мембрана представляет собой два параллельных слоя липидов (бимолекулярный слой, липидный бислой). Мембранные липиды имеют гидрофобную (углеводородные остатки жирных кислот и др.) и гидрофильную (фосфат, холин, коламин, сахар и т.п.) части. Молекулы липидов имеют полярную (гидрофильную) головку и неполярный (гидрофобный) нерастворимый в воде хвост.

Длина хвоста 5-6 нм. Такие молекулы образуют в клетке бимолекулярные слои: гидрофобные части их повернуты дальше от водного окружения, т.е. друг к другу, и удерживаются вместе сильными гидрофобными взаимодействиями и слабыми силами Лондона-Ван-дер-Ваальса. Таким образом, мембраны на обеих наружных поверхностях гидрофильны, а внутри гидрофобны. Поскольку гидрофильные части молекул поглощают электроны, они видны в электронном микроскопе как два темных слоя. При физиологических температурах мембраны находятся в жидкокристаллическом состоянии: углеводородные остатки вращаются вдоль своей продольной оси и диффундируют в плоскости слоя, реже перескакивают из одного слоя в другой, не нарушая прочных гидрофобных связей. Чем большую долю составляют ненасыщенные жирные кислоты, тем ниже температура фазового перехода (точка плавления) и тем более жидкой бывает мембрана. Более высокое содержание стеролов с их жесткими гидрофобными молекулами, лежащими в гидрофобной толще мембраны, стабилизирует мембрану (главным образом у животных).
Монослой и мицелла липосома
Мозаичная модель предполагает, что в основе мембраны липидный бислой, но в него полностью или частично погружены белки. В мембрану вкраплены различные мембранные белки. Некоторые из них находятся на внешней или на внутренней поверхности липидной части мембраны; другие пронизывают всю толщу мембраны насквозь. Мембраны полупроницаемы; они обладают мельчайшими порами, через которые диффундируют вода и другие небольшие гидрофильные молекулы. Для этого используются внутренние гидрофильные области интегральных мембранных белков или отверстия между соприкасающимися интегральными белками (туннельные).
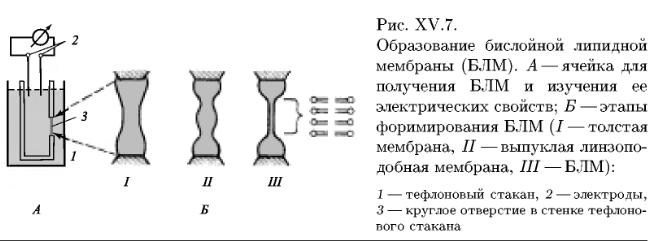
Модельные липидные мембраны. Для изучения структуры и функций мембран используются модельные искусственные мембраны. Самая простая модель – монослой на поверхности воды. Плоские бислойные фосфолипидные мембраны (БЛМ) - тип модельных мембран. Такие мембраны получают на маленьких отверстиях диаметром около 1 мм, в пластинке из пластика (например, фторопласта), погруженной в водную среду. На отверстие наносят каплю раствора липида (в спирте, хлороформе, гептане или других растворителях). Растворитель диффундирует из раствора в воду и на отверстии остается пленка липида. Эта пленка спонтанно утончается до тех пор, пока не образуется бимолекулярный слой толщиной около 6 нм. Лишний липид собирается в виде ободка - торуса у краев отверстия.
Липиды, спонтанно образующие ламеллярные слои, обычно способны формировать бислойные структуры (БЛМ или «черные» пленки) на небольших отверстиях в тонких гидрофобных материалах. Это явление впервые было описано О. Мюллером и соавторами, которые получили БЛМ из фосфолипидов мозга на небольших отверстиях (0,5-5,0мм2) в тефлоновой перегородке, разделяющей две водные фазы. Доказав бислойность сформированных мембран, авторы с помощью простой электроизмерительной техники охарактеризовали важнейшие электрические параметры этих мембран. Относительная простота получения БЛМ, широкий спектр применения разнообразных электроизмерительных методов исследования, возможность изменять в широких пределах липидный состав БЛМ и состав омывающих растворов, включать в БЛМ разнообразные модификаторы барьерных свойств мембран, функционально активные элементы биологических мембран — все это быстро обеспечило этим искусственным мембранным системам центральное место в современной экспериментальной мембранологии. Общая схема ячейки для формирования БЛМ и несколько последовательных этапов формирования бислойной структуры приведены на рис. XV. 7. Процесс образования БЛМ начинается с нанесения небольшого количества подходящего липида, растворенного обычно в жидких углеводородах (гексан, октан, декан и др.), на отверстие в тефлоновом стаканчике (рис. XV. 7,I). Далее эта толстая пленка самопроизвольно утоньшается вплоть до образования бислойной структуры (рис. XV.7, III).
Мультиламеллярные липосомы. Плоские ламеллярные структуры проявляют склонность (при энергичном встряхивании) образовывать замкнутые сферические частицы. Этот процесс энергетически выгоден, так как в этом случае достигается минимум площади контакта гидрофобных поверхностей с водой. При простых механических воздействиях образуются в основном многослойные частицы (диаметром в несколько микрометров) с концентрической организацией слоев - мультиламеллярные липосомы или везикулы (мешочки). В этих частицах липидные бислои отделяют внутреннюю водную фазу от внешнего раствора. Такая организация позволяет использовать мультиламеллярные липосомы для исследования барьерных свойств липидного бислоя. Мультиламеллярные липосомы осмотически активны: они изменяются в объеме при изменении осмотических свойств внешней среды.
Моноламеллярные липосомы. Более энергичное воздействие на грубые фосфолипидные дисперсии, например с помощью ультразвука, вызывает образование моноламеллярных (однослойных) везикул (диаметр 20-40 нм). В зависимости от эффективной конфигурации липидных молекул (критический параметр упаковки и заряд) размеры моноламеллярных липосом могут варьировать. Моноламеллярные липосомы широко используются в медико-биологических исследованиях. Однако малый внутренний объем и осмотическая неактивность снижают круг этих исследований. В последнее время разработаны методики получения больших (100 нм в диаметре и более) моноламеллярных липосом, которые лишены этих недостатков.
Плоские липидные мембраны, наряду с липосомами, широко используются в качестве моделей для изучения электрических свойств мембраны, их проницаемости для различных веществ и для других научных исследований. Модельные мембраны моделируют ряд функций биологических мембран, в том числе барьерную: например, селективность проницаемости - хорошую проницаемость для воды, плохую для ионов. Можно моделировать регулируемый транспорт, воздействуя на модельную мембрану белками - ионофорами, изменением температуры, химического состава окружающей среды, электрическим полем. Можно при этом наблюдать изменение ионной проницаемости модельных мембран. С помощью модификаторов можно изменить свойства модельных мембран (проводимость, селективность)
Как показано физическими методами исследования - дилатометрией (измерением коэффициента объемного расширения) и калориметрией (измерением теплоемкости), рентгеноструктурного анализа и др. - липидная часть биологических мембран при определенных температурах испытывает фазовый переход первого рода. Согласно данным рентгеноструктурного анализа, радиоспектроскопии, флюоресцентного анализа, инфракрасной спектроскопии и других физических исследований в фосфолипидной мембране при понижении температуры происходит переход из жидкокристаллического в гель-состояние, которое условно иногда называют твердокристаллическим.
В гель-состоянии молекулы расположены еще более упорядочено, чем в жидкокристаллическом. Все гидрофобные углеводородные хвосты фосфолипидных молекул в гель-фазе полностью вытянуты строго параллельно друг другу (имеют полностью трансконформацию). В жидком кристалле за счет теплового движения возможны структурные переходы: хвосты молекул изгибаются, их параллельность друг другу в отдельных местах нарушается, особенно сильно в середине мембраны. Толщина мембраны поэтому в гель-фазе больше, чем в жидком кристалле. Однако при переходе из твердого в жидко-кристаллическое состояние, объем несколько увеличивается, потому что значительно увеличивается площадь мембраны, приходящаяся на одну молекулу (от 0,48 нм2 до 0,58 нм2).
Для нормального функционирования мембрана должна быть в жидкокристаллическом состоянии. Поэтому в живых системах при продолжительном понижении температуры окружающей среды наблюдается адаптационное изменение химического состава мембран, обеспечивающее понижение температуры фазового перехода. Температура фазового перехода Тф.п. понижается при увеличении числа ненасыщенных связей в жирно-кислотных хвостах. В хвосте молекулы может быть до четырех ненасыщенных связей.
Поры в мембране. Окисление одной из жирнокислотных цепей фосфолипида или отщепление ее под воздействием фермента приводит к образованию молекулы, у которой размер "головки" в плоскости мембраны превышает размер гидрофобной части: такая молекула по форме ближе уже не к цилиндрической, а к конической. Такие дефектные молекулы, оказываясь в составе мембраны в одном месте, формируют пору.
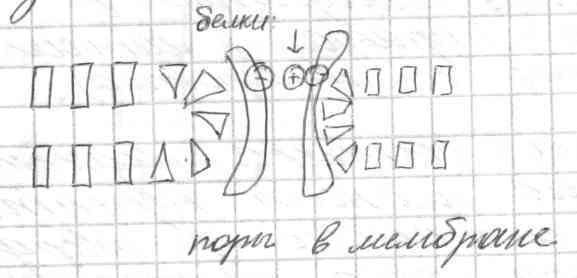
Через такую пору могут проходить вода и ионы. В результате мембрана теряет свои барьерные свойства. Поэтому перекисное окисление липидов и действие некоторых ферментов - процессы, ответственные за повреждение мембран при ряде заболеваний.
Механические свойства мембраны. Гидрофобный эффект, объединяющий молекулярные компоненты в мембранах, препятствует их выходу в водную фазу за пределы мембраны. В то же время силы межмолекулярного взаимодействия обычно не мешают молекулам в мембранах обмениваться друг с другом местами, поскольку площадь контакта между водой и гидрофобными участками молекул при этом практически не меняется. Вследствие этого молекулярные компоненты в мембранах сохраняют индивидуальную подвижность и могут диффузионным путем передвигаться в пределах мембран. Молекулы липидов наиболее легко совершают вращательное движение вокруг своей длинной оси. Время поворота на угол, равный 1 рад, в различных модельных и природных мембранах, находящихся в жидком состоянии, составляет 10-9 сек. Вращательная способность остается довольно высокой и при температуре ниже точки плавления. Диффузионное перемещение молекулы липидов вдоль слоя, обычно называемое латеральной диффузией, также совершается достаточно быстро. За 1 секунду молекула липида в среднем перемещается на 5000нм, то есть может обежать всю плазматическую мембраны такой клетки, как эритроцит. Скорость латеральной диффузии существенно зависит от липидного состава мембран и температуры. Так, добавление холестерина снижает скорость латеральной диффузии более чем в 2 раза. При температурах ниже точки плавления скорость латеральной диффузии снижается на порядок и более. Другой тип движения молекул липидов в мембранных системах - это трансбислойное движение (флип-флоп переход). Оно осуществляется в мембранах с относительно малой скоростью, потому что имеется высокий барьер для пересечения гидрофильной головкой молекулы липида углеводородной зоны мембраны. Скорость флип-флоп перехода оценивают по времени, за которое половина молекул-меток перейдет из одного слоя в другой. В модельных везикулярных системах это время оставляет 10-20 часов. В природных мембранах этот процесс может идти существенно быстрее. Из-за того, что скорости флип-флоп перехода асимметричны, внутренняя и наружная поверхности мембран имеют различный белковый и липидный состав. Молекулы белков в мембранах также проявляют диффузионную подвижность, однако вследствие большей массы они движутся медленнее. Асимметричная (относительно плоскости мембраны) ориентация транспортных белков
39. Транспорт неэлектролитов через мембраны. Диффузия, коэффициент распределения вещества на мембране, проницаемость мембраны. Другие механизмы проницаемости: проникновение через поры, облегчённая диффузия при участии переносчиков.
Целый ряд процессов в клетке, например таких, как возбуждение, синтез АТФ, поддержание постоянства ионного состава и содержания воды, связан с переносом веществ через биологические мембраны. Изменение скорости переноса веществ может приводить к нарушению водно-солевого обмена и другим нарушениям. Коррекция этих изменений лежит в основе действия большого кол-ва лекарственных препаратов.
Транспорт веществ через мембрану можно разделить на пассивный (без затрат энергии) и активный (с затратами химической энергии). К пассивному транспорту относится простая диффузия (малые молекулы, например вода, кислород), перенос через каналы (квантованность переноса – соответствие диаметра канала и диаметра гидратированного иона), перенос с помощью переносчиков.

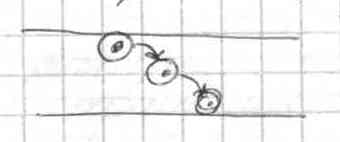 эстафетный перенос
эстафетный перенос
При участии переносчиков диффузия идет с большей скоростью и имеет место эффект насыщения.
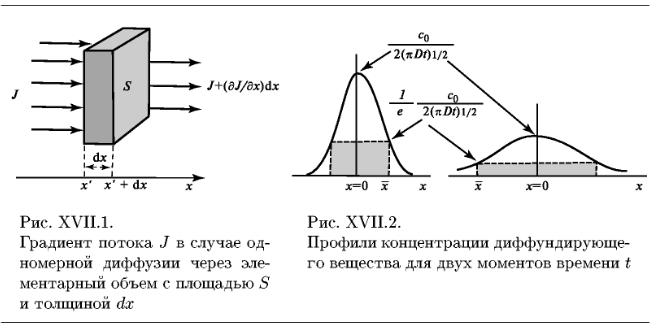
Диффузия описывает поток молекул, обладающих подвижностью. Поток – количество вещества, протекающего через единицу поверхности в единицу времени. Движущей силой диффузии через мембрану является разность химических потенциалов  этого вещества между областями, разделенными мембраной. Химический потенциал равен
этого вещества между областями, разделенными мембраной. Химический потенциал равен
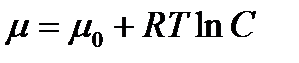
где 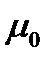 - стандартный химический потенциал, С – концентрация вещества.
- стандартный химический потенциал, С – концентрация вещества.
Транспорт неэлектролитов происходит по механизму диффузии. Поток вещества I в направлении оси х пропорционален градиенту концентрации 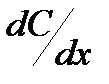 (закон Фика)
(закон Фика)
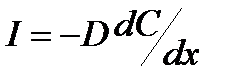 , (1)
, (1)
где D - коэффициент диффузии [см2*с-1]. зависящий от температуры и подвижности u вещества в среде:
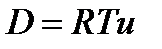 (2)
(2)
В случае тонкой мембраны градиент концентрации постоянен - 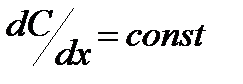 и движущая сила равна разности концентраций С1 и С2 в омывающих мембрану растворах
и движущая сила равна разности концентраций С1 и С2 в омывающих мембрану растворах
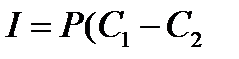
где Р - коэффициент проницаемости мембраны для данного вещества.
Проницаемость зависит от коэффициентов диффузии D и распределения 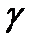 вещества между водной и липидной фазами и уменьшается с увеличением толщины hмембраны
вещества между водной и липидной фазами и уменьшается с увеличением толщины hмембраны
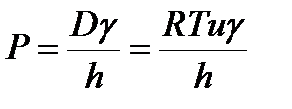 (3)
(3)
Существует определенная корреляция между проникающей способностью веществ и их растворимостью в липидах, что справедливо в случае больших гидрофобных молекул. Однако малые гидрофильные молекулы могут проникать по водным порам или перемещаться вместе с диффузией кинков через углеводородную зону. Неэлектролиты проникают в гидрофобную часть мембраны или в узкую пору, при условии, что они теряют свою гидратную оболочку. Необходимо затратить определенную энергию, чтобы "оторвать" диполи воды от полярных групп молекулы ( -СООН, -ОН, NH2). Это определяет причину сильной температурной зависимости коэффициента проницаемости мембран для ряда неэлектролитов. Другим видом пассивного транспорта является облегченная диффузия аминокислот и сахаров. Она отличается от простой диффузии высокой специфичностью по отношению к транспортируемому веществу, насыщением скорости диффузии при увеличении концентрации вещества, чувствительностью к действию определенных ингибиторов. Все это говорит о сходстве облегченной диффузии с ферментативными процессами и указывает на участие переносчиков в этом процессе. Формально начальная скорость переноса вещества описывается уравнением, аналогичным уравнению Михаэлиса-Ментен:
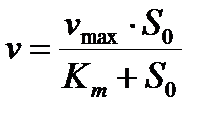 (4)
(4)
где S0 -концентрация вещества в наружном растворе. Концентрация вещества внутри 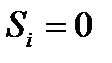 в начальный момент времени. По мере роста S0 все переносчики оказываются связанными и дальнейшего увеличения скорости диффузии уже не происходит. Движущей силой транспорта с участием переносчика будет градиент химического или электрохимического потенциала переносимого вещества. Существуют переносчики, которые одновременно переносят и аминокислоту, и ион, фиксируя их на двух центрах связывания (например, в эритроцитах). Таким же образом происходит транспорт глюкозы в сердечной мышце с образованием комплекса переносчика П с Na+ и глюкозой
в начальный момент времени. По мере роста S0 все переносчики оказываются связанными и дальнейшего увеличения скорости диффузии уже не происходит. Движущей силой транспорта с участием переносчика будет градиент химического или электрохимического потенциала переносимого вещества. Существуют переносчики, которые одновременно переносят и аминокислоту, и ион, фиксируя их на двух центрах связывания (например, в эритроцитах). Таким же образом происходит транспорт глюкозы в сердечной мышце с образованием комплекса переносчика П с Na+ и глюкозой

Движение этого комплекса облегчается за счет взаимодействия заряда Na+ с электрическим полем. Подчеркнем, что в пассивном транспорте энергия метаболизма не тратится на поддержание градиентов. При выравнивании градиентов в процессе диффузии в системе наступает равновесие и облегченная диффузия прекращается.



40. Электрохимический потенциал. Роль электрохимического потенциала в пассивном транспорте. Ионное равновесие на границе фаз.
Если происходит перенос ионов, то их движение зависит не только от концентрации, но и от электрического потенциала 
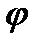 на мембране. В этом случае пользуются понятием электрохимического потенциала
на мембране. В этом случае пользуются понятием электрохимического потенциала 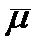
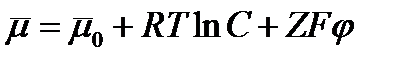
где Z - валентность иона, F - число Фарадея (96500 Кулон/моль). Непосредственно движущей силой переноса ионов является градиент электрохимического потенциала 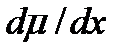 . Основной энергетический барьер, который стоит на пути проникновения ионов в липидную мембрану из водной фазы, возникает из-за того, что диэлектрическая постоянная липидов
. Основной энергетический барьер, который стоит на пути проникновения ионов в липидную мембрану из водной фазы, возникает из-за того, что диэлектрическая постоянная липидов 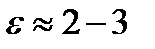 , а у воды
, а у воды 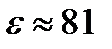 . Вследствие этого энергия иона как заряженной частицы радиуса r и заряда е , равная
. Вследствие этого энергия иона как заряженной частицы радиуса r и заряда е , равная
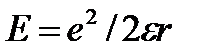 , повышается в липидном слое. Отсюда следует, что коэффициент распределения концентраций иона между водной и липидной фазами должен быть очень мал:
, повышается в липидном слое. Отсюда следует, что коэффициент распределения концентраций иона между водной и липидной фазами должен быть очень мал:
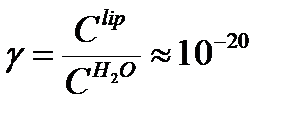

где 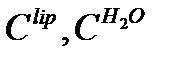 - концентрации ионов в фазах у самой границы раздела.
- концентрации ионов в фазах у самой границы раздела.
Вывод формулы Нернста 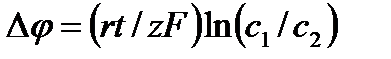 для ионного равновесия между водными растворами электролита, разделенными мембраной.
для ионного равновесия между водными растворами электролита, разделенными мембраной.
В случае равновесия по ионам одного типа электрохимические потенциалы ионов в обеих частях раствора одинаковы: 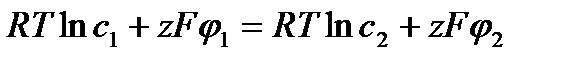 . Отсюда для разности потенциалов получаем
. Отсюда для разности потенциалов получаем 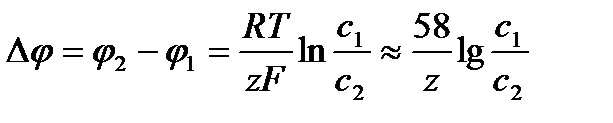 (мв).
(мв).
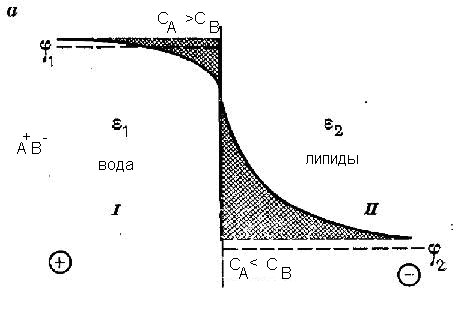
Равновесие на границе водного электролита с неполярной жидкостью. Межфазный объёмный скачок потенциала. Изменение потенциала вблизи границ раздела фаз.


Приближённое решение уравнения Пуассона-Больцмана. Дебаевский радиус экранирования.
Возникновение межфазной разности потенциалов связано с разделением зарядов в окрестностях границы раздела и с образованием двойного электрического слоя. Вопрос о характере распределения электрического потенциала в двойном слое, в частности вблизи границы раздела вода-неполярный растворитель, решается на основании одного из основных уравнений электростатики — уравнения Пуассона. Для рассматриваемого одномерного случая (одна пространственная координата — х) это уравнение имеет вид
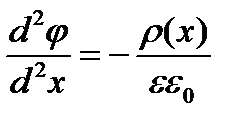 (XVIII.4.2)
(XVIII.4.2)
где р(х) —плотность электрических зарядов в плоскости х:
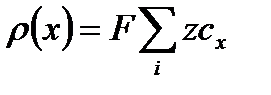 , (XVIII.4.3)
, (XVIII.4.3)
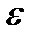 — абсолютная диэлектрическая постоянная, принимающая значения
— абсолютная диэлектрическая постоянная, принимающая значения 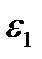 при х < О и
при х < О и 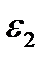 при х > 0. Уравнение Пуассона связывает вторую производную потенциала в плоскости х с плотностью зарядов в этой плоскости. Если концентрацию электролита в объеме фазы принять равной с, то, учитывая уравнение Больцмана (XVIII.4.1), плотность зарядов может быть записана в виде
при х > 0. Уравнение Пуассона связывает вторую производную потенциала в плоскости х с плотностью зарядов в этой плоскости. Если концентрацию электролита в объеме фазы принять равной с, то, учитывая уравнение Больцмана (XVIII.4.1), плотность зарядов может быть записана в виде
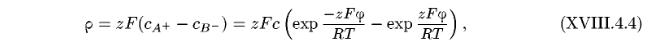
где 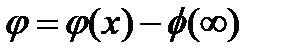 — потенциал в плоскости х относительно потенциала в объеме фазы
— потенциал в плоскости х относительно потенциала в объеме фазы 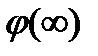 , a z = z+ = —Z-. Для случая, когда значение потенциала на границе раздела
, a z = z+ = —Z-. Для случая, когда значение потенциала на границе раздела 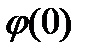 относительно потенциала в объеме фазы невелико, экспоненциальные члены в уравнении (XVIII.4.4) могут быть разложены в ряд.
относительно потенциала в объеме фазы невелико, экспоненциальные члены в уравнении (XVIII.4.4) могут быть разложены в ряд.
После введения подобных упрощений уравнение Пуассона—Больцмана принимает вид
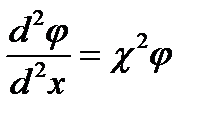 , (XVIII.4.5)
, (XVIII.4.5)
где 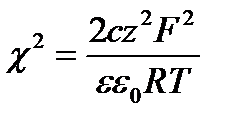 (XVIII.4.6)
(XVIII.4.6)
Решение уравнения (XVIII.4.5) имеет вид (приближение Дебая, или модель Гуи)
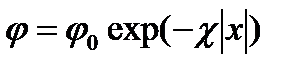 , (XVIII.4.7)
, (XVIII.4.7)
где 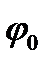 и
и 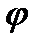 — значения электрического потенциала на границе раздела и в плоскости х, измеряемые относительно потенциала в объеме фазы: |x|—абсолютное значение координаты х. Уравнение (XVIII.4.7) показывает, что электрический потенциал изменяется экспоненциально с изменением расстояния от границы раздела (рис. XVIII.4). Двойной электрический слой распространяется в глубь обеих фаз, по обе стороны от поверхности раздела. Крутизна изменения потенциала в зависимости от расстояния определяется величиной х, которая зависит от концентрации ионов в данной фазе и диэлектрической проницаемости. Величина
— значения электрического потенциала на границе раздела и в плоскости х, измеряемые относительно потенциала в объеме фазы: |x|—абсолютное значение координаты х. Уравнение (XVIII.4.7) показывает, что электрический потенциал изменяется экспоненциально с изменением расстояния от границы раздела (рис. XVIII.4). Двойной электрический слой распространяется в глубь обеих фаз, по обе стороны от поверхности раздела. Крутизна изменения потенциала в зависимости от расстояния определяется величиной х, которая зависит от концентрации ионов в данной фазе и диэлектрической проницаемости. Величина 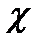 принимает значение
принимает значение 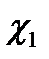 и
и 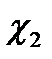 для фаз 1 и 2 соответственно. Основное изменение потенциала вблизи границы раздела происходит на расстоянии, равном
для фаз 1 и 2 соответственно. Основное изменение потенциала вблизи границы раздела происходит на расстоянии, равном 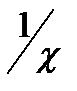 . Величина
. Величина 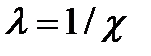 характеризует толщину каждой обкладки диффузного двойного слоя и называется длиной экранирования или дебаевской длиной.
характеризует толщину каждой обкладки диффузного двойного слоя и называется длиной экранирования или дебаевской длиной.
На поверхности мембраны могут быть заряды, которые обусловлены диссоциацией ионных групп биополимеров. Распределение ионов определяется двумя факторами: 1) специфической адсорбцией на заряженной поверхности и 2) балансом кулоновских сил притяжения противоионов и отталкивания ионов одного знака и броуновской диффузией.
Наличие фиксированных поверхностных зарядов клеточных мембран приводит к образованию около мембраны двойного электрического слоя, который является важным фактором в протекании многих биоэлектрохимических процессов.
Согласно представлениям, развитым в работах Г. Гуи и Д. Л. Чэпмена (1910) распределение ионов в области заряженной поверхности определяется двумя факторами: электростатическим притяжением, удерживающим противоионы у поверхности, и тепловым движением этих ионов, стремящимся, наоборот, к выравниванию их концентраций в поверхностном слое и объеме. В устанавливающемся равновесии плотность распределения ионов около заряженной поверхности убывает с увеличением расстояния от поверхности. Равновесные концентрации катионов с+ и анионов с- в поверхностном слое и в объеме раствора представлены схематически на рис. XVIII.5. Слой раствора с измененными концентрациями вблизи поверхности называется диффузным. В зависимости от условий его толщина изменяется на несколько порядков — от десятых нанометра до микрометров.
изменяется на несколько порядков — от десятых нанометра до микрометров.

Решение уравнения Пуассона – Больцмана для распределения потенциала и плотности поверхностного заряда. Предельные случаи толстого и тонкого диффузного двойного слоя.




Электрокинетический потенциал, формулы Генри и Смолуховского. Измерение электрокинетического потенциала.


Вывод формулы Генри 
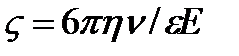 для электрокинетического потенциала заряженной частицы в слабом электролите. В модели Генри предполагается, что заряженная частица движется равномерно под действием сил электрического поля и трения (сила Стокса). Поверхностный потенциал частицы совпадает с электрокинетическим
для электрокинетического потенциала заряженной частицы в слабом электролите. В модели Генри предполагается, что заряженная частица движется равномерно под действием сил электрического поля и трения (сила Стокса). Поверхностный потенциал частицы совпадает с электрокинетическим 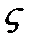 - потенциалом. Равномерное движение возможно при равенстве сил электрического поля
- потенциалом. Равномерное движение возможно при равенстве сил электрического поля 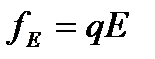 и силы трения
и силы трения 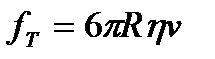 , где R- радиус частицы,
, где R- радиус частицы, 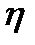 - коэффициент вязкости жидкости, v – скорость равномерного движения. Считая, что заряд частицы можно вычислить через ее потенциал по формуле электростатики
- коэффициент вязкости жидкости, v – скорость равномерного движения. Считая, что заряд частицы можно вычислить через ее потенциал по формуле электростатики 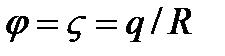 и приравнивая силы
и приравнивая силы 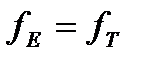 , получаем формулу Генри
, получаем формулу Генри 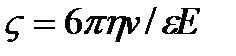 .
.
41. Доннановское равновесие между фазами. Пассивный ионный транспорт. Уравнение Нернста-Планка. Два подхода к решению уравнения Нернста-Планка: теория Гендерсона и теория Гольдмана-Ходжкина-Хаксли (приближение постоянного поля). Вольтамперные характеристики мембраны. Уравнение Ходжкина-Хаксли для трансмембранного потенциала при наличии трёх типов ионов. Однонаправленные потоки и соотношение Уссинга.
Доннановское равновесие между фазами - это вид ионного равновесия между фазами, когда одна из фаз несет заряженные частицы , неспособные перейти в другую фазу. Допустим , что две водные фазы , в каждой из которых растворен электролит А+В- , разделены мембраной, проницаемой для электролита. Пусть в одной из фаз (фаза2) имеются положительные фиксированные заряды Q, которые не могут проходить через мембрану. При условии равновесия для подвижного иона одного типа электрохимические потенциалы в обоих растворах (1 и 2) одинаковы
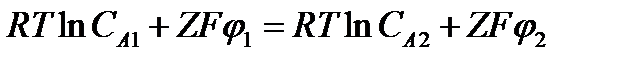 и
и 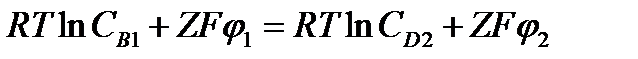
Из этих условий равновесия получаем уравнение для разности потенциалов

которое называется уравнением Нернста для равновесного потенциала на мембране. Оно показывает, что равновесный потенциал на мембране определяется соотношением концентраций электролита в обеих фазах.
Пассивный ионный транспорт. Уравнение Нернста-Планка. Два подхода к решению уравнения Нернста-Планка: теория Гендерсона и теория Гольдмана-Ходжкина-Хаксли (приближение постоянного поля). Уравнение Ходжкина-Хаксли для трансмембранного потенциала при наличии трёх типов ионов.









42. Индуцированный ионный транспорт. Факторы, снижающие барьер проникновения иона через мембрану. Типы индуцированного переноса («малая и большая карусель», коллективный, эстафетный и прямой транспорт).
Затраты энергии, необходимые для проникновения иона в неполярную фазу, можно оценить по формуле Борна, согласно которой энергия иона радиусом r в среде с диэлектрической проницаемостью 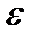 определяется формулой
определяется формулой
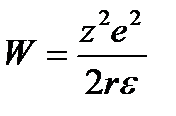
Энергия, затрачиваемая на перемещение иона из воды в мембрану, зависит от его радиуса и диэдектрических проницаемостей воды 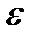 в и мембраны
в и мембраны 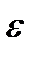 м.
м.
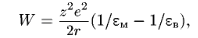 (1)
(1)

Как видно из уравнения (1), энергия перехода иона в мембрану снижается с увеличением радиуса иона. Поэтому крупные органические ионы проникают через мембрану легче, чем маленькие ионы щелочных металлов.
Кроме того, величина энергетического барьера в мембране уменьшается, а следовательно, проницаемость мембраны для иона возрастает не только при увеличении его радиуса, но и при приближении значений диэлектрических проницаемостей воды 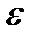 в и мембраны
в и мембраны 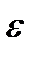 м. На этих физических принципах основан облегченный перенос ионов. Переносчики (ионофоры) могут образовывать с ионом комплекс большого размера. Либо в мембране может формироваться пора, заполненная водой – канал.
м. На этих физических принципах основан облегченный перенос ионов. Переносчики (ионофоры) могут образовывать с ионом комплекс большого размера. Либо в мембране может формироваться пора, заполненная водой – канал.
Перенос иона через мембрану с участием переносчика включает стадии образования комплекса иона с ионофором на одной стороне мембраны, перемещения комплекса через мембрану, освобождения иона на другой стороне и возвращения ионофора. Возможны две схемы работы переносчика: малая «карусель», когда ионофор не выходит из мембраны, и большая «карусель», когда ионофор проходит мембрану насквозь, а образование и распад комплексов протекает в неперемешиваемых слоях около мембраны. По механизму малой карусели осуществляется, например, перенос К+ в присутствии валиномицина. Среди соединений, относящихся к ионным переносчикам, центральное место занимают макроциклические антибиотики, выделенные из микроорганизмов.

Движение иона значительно облегчается, если молекулы ионофора образуют комплекс, имеющий водную пору — канал. Наиболее известными каналообразующими соединениями являются грамицидин А, аламетицин, амфотерицин, моназомицин и полиеновые антибиотики.
Все эти молекулы обладают сродством к водной и органической фазам, что, с одной стороны, позволяет им образовывать водную пору, а с другой —приводит к сильной сорбции антибиотика на мембрану. Внешняя часть молекул в поре гидрофобна, а внутрь канала обращены хорошо поляризуемые группы. Заряженные или сильно полярные группы могут находиться на одном конце молекулы. Такие группы служат «якорем», удерживая полярный конец на одной из сторон мембраны, позволяя молекуле пронизать гидрофобную часть мембраны.
Находясь в мембране, молекула грамицидина сворачивается в спиралевидную структуру – полупору, стабилизированную гидрофобными связями, и формирует полый цилиндр длиной около 3 нм и диаметром поры около 0.5-0.8 нм. По такому каналу может переноситься около 107 ионов в секунду. При входе иона в грамицидиновый канал происходит частичное замещение воды гидратной оболочки на карбонильные группы, ображенные внутрь поры. При добавлении небольших количеств грамицидина к искусственной бислойной липидной мембране наблюдаются скачкообразные изменения тока через мембрану.
Ионный транспорт в каналах







43. Активный мембранный транспорт. Основные экспериментальные факты по активному транспорту ионов. Основные представления о термодинамике и схеме рабочего цикла Na-насоса. Основные понятия о транспорте ионов Ca2+ и H+. Влияние активного транспорта на трансмембранный потенциал.
Системы активного транспорта обеспечивают перенос ионов против градиента электрохимического потенциала и используют для этого энергию метаболизма.
Существование градиентов концентрации Na, K, Ca между внутри и внеклеточной средой - основное условие поддержания потенциала покоя и электрической возбудимости нервных и мышечных клеток. Ионы, способные проникать через мембрану, могут накапливаться в клетке или вытесняться из нее в соответствии с градиентом мембранного электрохимического потенциала. Так, несмотря на существование значительного градиента концентрации К+ между клетками и окружающей средой, эти ионы находятся почти в равновесии. При этом градиент концентрации и градиент потенциала направлены в противоположные стороны. Распределение Na значительно отличатся от равновесного: оба компонента пассивного потока - по градиенту концентрации и в направлении электрического поля - направлены внутрь клетки. Для поддержания низкого неравновесного уровня концентрации Na+ в клетке необходим механизм активного выведения натрия в среду. Системы активного транспорта обеспечивают перенос ионов против градиента электрохимического потенциала за счет энергии АТФ (Na+ -насос плазматических мембран, Ca2+ -насос мембран саркоплазматического ретикулума) или энергии окислительно-восстанивительных реакций (Н+ -насос митохондрий, хлоропластов и других энергосопрягающих мембран). Активный транспорт Na+ в нервных клетках осуществляется Na+ , К+ -АТФазой, локализованной в плазматических мембранах. Принцип действия Na+ , К+ -АТФазы состоит в том, что за счет освобождающейся при гидролизе АТФ энергии в ней происходят конформационные изменения , которые сопровождаются переносом ионов Na+ из клетки во внеклеточную среду и одновременно К+ - в обратном направлении.
Основные факторы, подтверждающие наличие активного транспорта:
- Фермент АТФ-азы расщепляет АТФ в присутствии ионов натрия и калия.
- Ингибирование АТФ-азы происходит при той же концентрации, при которой прекращает работу натриевый насос.
- Гидролиз АТФ идет в две стадии: вначале выделяется АDФ, фосфат связан с ферментом и эта стадия активируется ионами натрия. Отщепление фосфата от фермента активируется калием.
- Активность калий-натриевого насоса зависит от концентрации ионов натрия внутри клетки и от концентрации ионов калия снаружи.
- Опыты с меченой АТФ-азой показывают, что при гидролизе одной молекулы АТФ происходит транспорт двух ионов калия внутрь клетки и выход из клетки трех (иногда двух) ионов натрия.
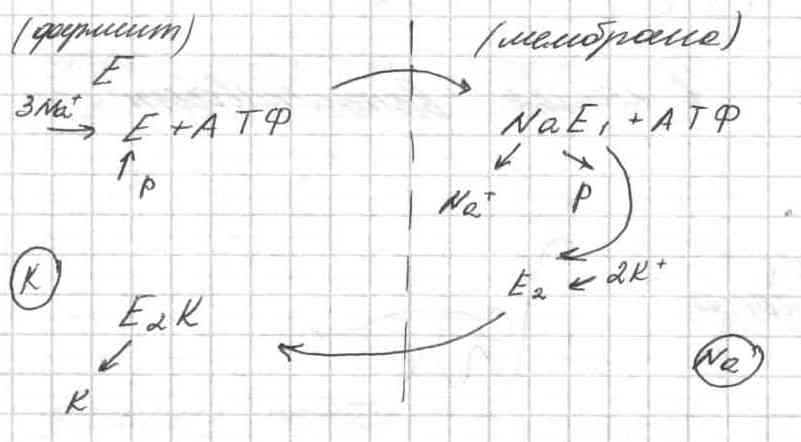
.Цикл работы калий-натриевого насоса при активном транспорте ионов через мембрану.
Упрощенная схема рабочего цикла калий-натриевого насоса включает следующие четыре фазы.
На первой фазе большая субъединица натрий-калиевой АТФазы (БС) связывается с 3-мя атомами натрия и фосфорилируется. Присоединение АТФ изменяет конформацию БС и ее сродство с ионами повышается. После фосфорилирования и замыкания ионов натрия в полости БС, в результате конформационных перестроек сродство комплекса к ионам натрия понижается, а к ионам калия - повышается.
На второй фазе малая субъединица (МС) входит в мембрану вместе с двумя атомами калия и полости для ионов совмещаются.
На третьей фазе происходит ионообменный процесс между субъединицами.
На четвертой фазе большая субъединица дефосфорилируется, ионы калия выходят в цитоплазму, атомы фосфора – во внешнюю среду, АДФ – внутрь клетки. Малая субъединица возвращается в исходное внешнее положение вместе с тремя ионами натрия, которые попадают во внешнюю среду.
В мембранах существует также Са2+ -зависимая АТФаза, имеющая ряд особенностей, сходных с Na+ , К+ -АТФазой. Ее рабочий цикл также включает связывание Са2+ и АТФ с образованием конформационно неустойчивого состояния, в котором изменяется сродство белка с ионом Са2+ за счет энергии макроэнергетической фосфатной связи. Как и в случае Na+ , К+ -АТФазы, изменение сродства здесь обусловлено, по видимому, изменением расположения полярных групп, связывающих Са2+ в координационной сфере центра фермента.
Са2+ -зависимая АТФаза, сопряженная с ионом Са2+ , локализована в мембранах саркоплазматической сети. Са2+ -зависимая АТФаза состоит из одной полипептидной цепи с молекулярной массой около 100000 и относительно высоким содержанием гидрофобных аминокислот (аминокислоты с неполярными боковыми цепями). Для работы Са2+ -зависимой АТФазы также необходимо присутствие фосфолипидов.
Работу Са2+ -зависимой АТФазы изучают на фрагментах саркоплазматического ретикулума, выделяемых из мышечной ткани, а также на мембранных пузырьках, которые образуются в определенных условиях в смеси очищенного препарата Са2+ -зависимой АТфазы с фосфолипидами. Схема работы Са2+ -АТФазы может быть представлена следующим образом. На первом этапе происходит связывание Са2+ и АТФ. Эти соединения связываются с разными центрами на внешней поверхности мембранного пузырька. На втором этапе АТФ гидролизуется с образованием фосфорилированного фермента. Образование фермент-фосфатного комплекса можно обнаружить по включению в белок радиоактивного изотопа 32Р из АТФ, меченой по фосфату. Образующаяся фосфорилированная форма фермента конформационно неустойчива и претерпевает изменение пространственной структуры таким образом, что ион-связывающие участки оказываются отделенными от внешней среды. Изменение конформации Са2+ - АТФазы проявляется в изменении сигнала ЭПР спиновой метки, присоединенной к белку, в связи с изменением подвижности метки.
На следующем этапе цикла происходит изменение сродства Са2+ -связывающих центров к ионам Са одновременно с изменением характера связи фосфатной группы с ферментом. Энергия, ранее сосредоточенная в макроэнергетической фосфатной связи, расходуется на изменение константы связывания ионов Са с ферментом. Как и в случае Na+ , К+ -АТФазы, изменение сродства обусловлено, по видимому, изменением расположения полярных групп, образующих координационные связи с Са. Вследствие происшедшего измения пространственной структуры фермента ионы Са получают доступ во внутреннее пространство мембранных пузырьков и выбрасываются во внутренний объем. Константа связывания Са2+ при образовании стабильной фосфорилированной формы фермента уменьшается на 3-4 порядка. Изменение свободной энергии при таком уменьшении константы связывания составляет 18 кДж/моль. Таким образом, суммарные затраты энергии на перенос иона Са через мембрану примерно вдвое меньше энергии гидролиза АТФ (около 40 кДж/моль), которой хватает на перенос двух ионов Са. В результате этих превращений фермент вновь приходит в исходное состояние.
В функционировании биоэнергетических систем важное место принадлежит транспорту протонов Н+. Перенос электронов в энергосопрягающих мембранах митохондрий, хлоропластов и бактерий сопровождается трансмембранным переносом Н+ и образованием градиента электрохимического потенциала.
Перенос Н+ через мембраны может осуществляться механизмами трех типов. В некоторых мембранах существуют подвижные переносчики протонов (пластохинон в фотосинтетической мембране хлоропластов). Возможны также конформационные переходы мембранного белка при связывании протона на одной стороне мембраны и депротонировании белка с другой стороны мембраны, сопряженные с поворотом макромолекулы в мембране, при котором присоединенный протон пересекает мембрану. Наконец, протоны могут транспортироваться через мембрану по специализированным структурам — Н+-каналам. Протонный канал представляет собой узкую полость, образованную полярными группами белка.
Транспорт протонов по Н+-каналам обычно сравнивают с переносом Н+ по регулярной решетке, образованной системой водородных связей, аналогичных таковой во льду. В структуре льда возможны переходы от одной молекулы воды к соседней. В результате возникает ионная пара, состоящая из положительно заряженного иона гидроксония Н3+ О и гидроксила ОН- . В отсутсвие электрического поля обмен протонами происходит хаотично, однако при создании разности потенциалов возникает направленная миграция дефектов. В итоге достигается быстрое смещение протонов вдоль упорядоченной цепи водородных связей.
В некоторых кристаллах (например имидазол) которые содержат систему водородных связей, ориентированных в определенном направлении, подвижность протона в направлении цепи этих связей в 1000 раз выше, чем в перпендикулярном направлении. В биологических мембранах системы водородных связей, по которым транспортируются протоны, образованы полярными группами, не участвующими в формировании Н-связей 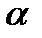 -спирали полипептидной цепи.
-спирали полипептидной цепи.

Активный мембранный транспорт может влиять на величину трансмембранного потенциала, и его значение в результате может отличаться от значения, даваемого уравнением Нернста-Планка.
| <== предыдущая лекция | | | следующая лекция ==> |
| Динамические свойства биологических процессов | | | Энзимология как учение о ферментах. Простые и сложные ферменты. 1 страница |
Дата добавления: 2016-04-02; просмотров: 4816;
