Опишите механизмы свертывания крови
Свертывание крови (синоним: вторичный гемостаз) приводит к образованию сгустка фибрина, который связывается с тромбоцитарной пробкой и укрепляет ее. Существует два механизма (пути) образования фибрина, оба состоят в активации растворенных в плазме белков-предшественников факторов свертывания (табл. 34-3). Независимо от механизма, процесс свертывания в конечном счете завершается превращением фибриногена в фибрин. Внешний механизм свертывания запускается высвобождением из мембран поврежденных клеток тканевого липопротеина (тромбопластина). Представляется, что именно внешний механизм играет ведущую роль в свертывании крови у человека. Внутренний механизм свертывания (рис. 34-5) запускается при взаимодействии субэндотелиального коллагена с циркулирующим фактором Хагемана (XII), высокомолекулярным кининогеном (ВМКГ) и прекалликреином (ПК). Последние два вещества участвуют также в образовании брадикинина.
Тромбин играет ключевую роль в процессе свертывания, поскольку он не только активирует тромбоциты (см. выше), но также ускоряет превращение факторов V, VIII и XIII из неактивной формы в активную. В свою очередь, активированные тромбоциты значительно ускоряют превращение протромбина в тромбин. Тромбин превращает фибриноген в растворимые фибрин-мономеры, которые полимеризуются на поверхности тромбоцитарной пробки. Для образования плотного, нерастворимого фибринового сгустка необходимо перекрестное связывание полимеров фибрина с помощью фактора XIII. Наконец, происходит ретракция сгустка (требующая участия тромбоцитов), в результате чего из него удаляется жидкость, что позволяет полностью закрыть дефект сосуда.
ТАБЛИЦА34-3.Факторы свертывания
| Фактор | Период полувыведения, ч |
| I Фибриноген | |
| Il Протромбин | |
| III Тканевой тромбопластин | — |
| IV Кальций | — |
| V Проакцелерин | |
| VII Проконвертин | |
| VIII Антигемофильный фактор | |
| IX Фактор Кристмаса | |
| X Фактор Стюарта | |
| Xl РТА-фактор (синоним: плазменный предшественник тромбопластина) | |
| XII Фактор Хагемана | |
| XIII Фибрин-стабилизирующий фактор |
Почему в неповрежденных тканях кровь не сворачивается?
Процесс свертывания происходит только в поврежденном участке благодаря его отграничению тромбоцитами pi поддержанию нормального крово-тока в неповрежденных тканях. Эндотелий неповрежденных сосудов вырабатывает простациклин (PGI2), который является мощным вазодилатато-ром, ингибирующим агрегацию тромбоцитов и помогающим ограничить первичный гемостаз поврежденным участком. Поддержание адекватного кро-вотока имеет важное значение для удаления активированных факторов свертывания, которые поглощаются клетками системы мононуклеарных фагоцитов (см. выше). В норме в плазме циркулируют многие ингибиторы свертывания, включая антитромбин III, протеины С и S, а также ингибитор тканевого пути свертывания. Антитромбин III соединяется с циркулирующими факторами свертывания (за исключением фактора VII) и инактивирует их. Протеин С специфически инактивирует факторы V и VIII. Гепарин оказывает свое антикоагулянтное действие, повышая активность антитромбина III. Протеин S повышает активность протеина С; дефицит любого из этих белков сопряжен с высоким риском тромбо-образования. Ингибитор тканевого пути свертывания подавляет активность фактора VII.
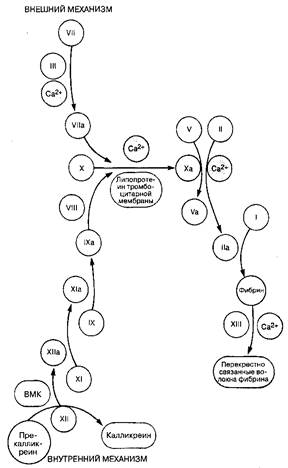
Рис. 34-5. Схема свертывания крови: внутренний и внешний механизмы BMK — высокомолекулярный кининоген
В чем состоит функция системы фибринолиза?
В норме система фибринолиза активируется одновременно со свертывающей, а роль ее состоит в поддержании жидкого состояния крови вне поврежденного участка. Кроме того, система фибринолиза обеспечивает лизис сгустков после начала регенерации тканей. В процессе свертывания в cryсток встраивается большое количество плазмино-гена. Под действием тромбина и фрагментов фактора Хагемана из эндотелиальных клеток высвобождается тканевой активатор плазминогена (ТАП). ТАП превращает плазминоген в плазмин, который расщепляет фибрин, фибриноген и другие факторы свертывания. Урокиназа (вырабатываемая в почках) и стрептокиназа (продукт жизнедеятельности бактерий) также являются мощными активаторами плазминогена. ТАП оказывает локальное действие, что обусловлено рядом причин: 1) ТАП абсорбируется на сгустке фибрина; 2) ТАП более эффективно активирует плазминоген, расположенный в сгустке фибрина; 3) свободный плазмин быстро нейтрализуется циркулирующим ингибитором — а2-антиплаз-мином. Плазмин расщепляет фибрин и фибриноген на неактивные фрагменты — продукты деградации фибрина, которые конкурируют с фибриногеном за тромбин и обладают поэтому антикоагулянтными свойствами. Продукты деградации фибрина удаляются из организма системой мононуклеарных фагоцитов. Лекарственные препараты эпсилон-ами-нокапроновая кислота (ЭАКК) и транексамовая кислота препятствуют связыванию плазмина с фибрином. Эндотелиальные клетки вырабатывают ингибитор активатора плазминогена (ИАП-1), который является антагонистом ТАП.
Какие нарушения свертываемости наиболее вероятны у обсуждаемого больного?
При тяжелых заболеваниях печени часто развивается коагулопатия, причины которой включают: 1) дефицит витамина К (нарушение всасывания или накопления); 2) нарушение синтеза факторов свертывания крови в печени и 3) секвестрация тромбоцитов в селезенке вследствие гиперсплениз-ма. При циррозе печени, кроме того, повышен риск кровотечения во многих тканях и органах (варикоз-ho расширенные вены пищевода, гастрит, пептиче-ские язвы, геморрой), что часто требует многократных гемотрансфузий. При тяжелых заболеваниях печени нарушается синтез ингибиторов факторов свертывания, а также способность удалять активированные факторы свертывания и продукты расщепления фибрина (нарушение функции клеток Куп-фера); в этом случае коагулопатия становится практически неотличимой от ДВС-синдрома.
Что такое диссеминированное внутрисосудистое свертывание (ДВС, ДВС-синдром)?
ёёЗапуск механизмов свертывания при ДВС-син-дроме происходит либо в результате высвобождения эндогенного тканевого тромбопластина или тромбопластиноподобных веществ, либо вследствие активации фактора XII — прямой (под действием эндотоксинов) или контактной (например, при искусственном кровообращении). В результате активации свертывания в сосудах микроциркулятор-ного русла откладывается фибрин, что вызывает потребление факторов свертывания, вторичный фибринолиз, тромбоцитопению и микроангиопа-тическую гемолитическую анемию. Следствием этих изменений является диффузная кровоточивость, а в некоторых случаях — тромбоэмболия. Лечение должно быть направлено на коррекцию основного патологического процесса, являющегося пусковым механизмом ДВС-синдрома. Симптоматическое лечение состоит в переливании факторов свертывания и тромбоцитов. Показания к применению гепарина четко не установлены; он может оказаться эффективным при тромбоэмболических осложнениях.
Что такое первичный фибринолиз?
Этим термином обозначают геморрагический диатез, обусловленный неуправляемым фибрино-лизом без предшествующего свертывания крови. Причины: дефицит А2-антиплазмина, дефицит ИАП-1, нарушение клиренса ТАП. Нарушение клиренса ТАП часто возникает при тяжелом заболевании печени, а также в ангепатическую фазу трансплантации печени (глава 35). Первичный фибринолиз может развиваться при раке предстательной железы (глава 33). Первичный фибринолиз следует заподозрить при геморрагическом диатезе, протекающем с низкой концентрацией фибриногена плазмы и нормальными показателями свертываемости и уровня тромбоцитов (см. ниже). Лечение: переливание свежезамороженной плазмы или криопреципитата, иногда применяют ЭАКК или транексамовую кислоту.
Какие лабораторные исследования наиболее информативны для оценки свертывания крови (вторичного гемостаза)?
Для оценки системы свертывания определяют частичное тромбопластиновое время (ЧТВ), про-тромбиновое время (ПВ), тромбиновое время (ТВ) и концентрацию фибриногена в плазме (табл. 34-4). ЧТВ характеризует внутренний механизм свертывания (факторы I, II, V, VIII, IX, X, XI и XII). Время свертывания крови и активированное время свертывания (ABC) также отражают внутренний механизм свертывания (глава 21). Напротив, ПВ характеризует внешний механизм свертывания (факторы I, II, V и VII). ТВ характеризует скорость превращения фибриногена в фибрин (факторы I и II). В норме концентрация фибриногена плазмы составляет 2-4 г/л (5,9-1,7 мкмоль/л). Поскольку гепарин влияет главным образом на внутренний путь свертывания, в малых дозах он вызывает только удлинение ЧТВ. Большие дозы гепарина увеличивают также и ПВ. Варфарин, напротив, оказывает действие преимущественно на витамин К-зави-симые факторы свертывания (II, VII, IX и X), так что его малые дозы вызывают удлинение ПВ, а ЧТВ увеличивается только при назначении больших доз. Активность плазмина in vivo можно оценить, измерив уровень циркулирующих в крови пептидов, образующихся при расщеплении фибрина и фибриногена под действием плазмина, а именно продуктов деградации фибрина (ПДФ) и D-ди-меров. При первичном фибринолизе обычно повышен уровень ПДФ, в то время как уровень D-димеров нормален.
Какие лабораторные исследования наиболее информативны для оценки первичного гемостаза?
Для оценки первичного гемостаза чаще всего определяют содержание тромбоцитов в крови и время кровотечения. Как правило, время кровотечения не увеличивается, если содержание тромбоцитов больше 100 000/мкл (1 мкл = 1 мм3). В норме количество тромбоцитов составляет 150 000-450 000 /мкл. Первичный гемостаз считают нормальным, если функция тромбоцитов не нарушена и их содержание превышает 100 000/мкл. Если содержание тромбоцитов составляет 50 000-100 000/мкл, то патологическая кровоточивость развивается только при тяжелой травме или обширных хирургических вмешательствах. Если содержание тромбоцитов < 50 000/мкл, то выраженная кровоточивость наблюдается даже при небольшой травме. При содержании тромбоцитов ниже 20 000/мкл часто возникают спонтанные кровотечения. Причины тромбоцитопении: (1) сниженное образование тромбоцитов в костном мозге; (2) секвестрация тромбоцитов в селезенке; (3) повышенное разрушение тромбоцитов. Повышенное разрушение тромбоцитов может носить иммунный (иммунная тромбоцитопеническая пурпура) или неиммунный (тромбоцитопения при васкулитах или ДВС-синдроме) характер.
ТАБЛИЦА 34-4.Нарушения показателей свертываемости при геморрагических диатезах
| ПВ | ЧТВ | ТВ | Фибриноген | |
| Тяжелое заболевание печени | | | H или | H или ¯ |
| ДВС-синдром | | | | ¯ |
| Дефицит витамина К | | | H | H |
| Лечение варфарином | | | H | H |
| Лечение гепарином | | | | H |
| Гемофилия Дефицит фактора VIII Дефицит фактора IX | H H | | H H | H H |
| Дефицит фактора VII | | H | H | H |
| Дефицит фактора XIII | H | H | H | H |
H — норма
Удлинение времени кровотечения при нормальном уровне тромбоцитов свидетельствует о нарушении их функции. Хотя время кровотечения в некоторой степени зависит от применяемой методики, его считают повышенным при значениях > 10 мин. Если время кровотечения > 15 мин, то очень высок риск значительного кровотечения в интра- или послеоперационном периоде. Для детальной оценки функции тромбоцитов применяют специальные методы исследования.
Каковы наиболее распространенные причины нарушения функции тромбоцитов?
Наиболее распространенной причиной нарушения функции тромбоцитов является угнетение образования тромбоксана A2 аспирином и нестероид-ными противовоспалительными средствами (НПВС). Аспирин необратимо ацетилирует цикло-оксигеназу, так что после его приема тромбоциты находятся в инактивированном состоянии все время своего существования в кровотоке — 7 суток. В отличие от аспирина, НПВС ингибируют цикло-оксигеназу только на 24 ч.
Что такое болезнь фон Виллебранда?
Болезнь фон Виллебранда является наиболее распространенным наследственным геморрагическим диатезом (частота составляет 1:800—1:1000). Причины: снижение концентрации ФфВ в плазме (норма: 5-10 мг/л), выработка аномальной формы ФфВ. Большинство больных гетерозиготны по дефектному гену, поэтому у них отмечается относительно умеренная кровоточивость, проявляющаяся клинически только при больших операциях, травмах, а также после приема аспирина и НПВС. ФфВ не только участвует в адгезии и агрегации тромбоцитов, но также служит переносчиком VIII фактора свертывания. В типичных случаях удлинено время кровотечения, снижена концентрация ФфВ в плазме и уменьшена активность VIII фактора свертывания. Приобретенные формы болезни фон Виллебранда встречаются при некоторых иммунных нарушениях, а также при опухолях, абсорбирующих на своей поверхности ФфВ. Выделяют легкую, среднетяжелую и тяжелую форму болезни. Десмопрессин повышает концентрацию ФфВ в плазме при легкой форме болезни фон Виллебранда и у здоровых людей. Десмопрессин назначают в дозе 0,3 мкг/кг за 30 мин до операции. Если Десмопрессин неэффективен, то показано переливание криопреципитата или концентрата VIII фактора свертывания (эти препараты крови содержат большое количество ФфВ). Чтобы гарантировать адекватный хирургический гемостаз, криопреци-питат или концентрат VIII фактора следует переливать каждые 12 ч до операции и после нее в течение 2-4 сут. Высокая очистка и тепловая обработка концентратов VIII фактора снижают риск заражения вирусными заболеваниями (глава 29).
Какие другие наследственные геморрагические диатезы встречаются в анестезиологической практике?
Наиболее распространенным наследственным дефектом вторичного гемостаза является дефицит фактора VIII (гемофилия А). Это заболевание сцеплено с Х-хромосомой и встречается у мужчин с частотой 1:10 000. Тяжесть заболевания обратно пропорциональна активности фактора VIII. Характерные клинические проявления включают гемар-трозы, кровоизлияния в глубоколежащие ткани и гематурию. Эти симптомы развиваются при снижении активности фактора VIII < 5%. Выявляют удлинение ЧТВ, в то время как ПВ и время кровотечения нормальны. Диагноз верифицируют определением активности VIII фактора в крови. Если концентрация фактора VIII > 30%, то в ходе операции обычно не возникает повышенная кровоточивость, но большинство исследователей рекомендует в предоперационном периоде повысить содержание фактора VIII в крови до > 50%. В 1 мл СЗП содержится 1 единица активности VIII фактора, в 1 мл криопреципитата — 5-10 единиц, в 1 мл концентрата фактора VIII — около 40 единиц. Введение фактора VIII в дозе 1 ед/кг повышает его концентрацию в плазме на 2%. Высокий риск заражения вирусными инфекциями послужил толчком к разработке и производству рекомбинантных и моноклональных очищенных концентратов фактора VIII, которые все шире внедряются в клиническую практику. Препараты фактора VIII следует переливать 2 раза в сутки из-за относительно короткого периода полувыведения (8-12 ч). В некоторых случаях применение десмопрессина позволяет в 2-3 раза повысить уровень фактора VIII. В качестве вспомогательного лечения можно назначить ЭАКК или транексамовую кислоту.
Гемофилия В (синоним: болезнь Кристмаса) представляет собой наследственный дефицит фактора IX, сцепленный с Х-хромосомой. Клинически заболевание очень напоминает гемофилию А, но встречается гораздо реже (1:100 000 мужчин). Диагноз верифицируют измерением концентрации фактора IX в крови. В периоперационном периоде для поддержания активности фактора IX > 30% от нормы рекомендуется переливание СЗП. Производятся рекомбинантные и моноклональные очищенные концентраты IX фактора, которые имеют преимущества перед СЗП (см. выше).
Дефицит XIII фактора встречается крайне редко. Он характерен тем, что ЧТВ, ПВ, ТВ и время кровотечения не увеличены. Для подтверждения диагноза следует измерить уровень фактора XIII в крови. Поскольку для обеспечения гемостаза достаточно повысить активность фактора XIII в крови до 1% от нормы, однократное переливание СЗП является адекватным методом лечения.
Позволяют ли нормальные данные лабораторных исследований исключить нарушение гемостаза?
Отсутствие отклонений при стандартном лабораторном исследовании гемостаза не позволяет полностью исключить геморрагический диатез. Некоторые дефекты гемостаза не обнаруживаются с помощью стандартных методик, для их выявления необходимы более специализированные исследования. На дефект гемостаза указывает повышенная кровоточивость после удаления зуба, во время родов, при небольших хирургических вмешательствах и травмах, во время менструации. Геморрагический диатез в семейном анамнезе позволяет заподозрить наследственное нарушение свертываемости крови, но больные могут не указывать на эти заболевания у своих родственников, поскольку кровоточивость часто увеличена незначительно и остается незамеченной.
Дифференциальный диагноз нарушений гемостаза часто можно провести на основании клинической картины. При нарушениях первичного гемостаза кровотечения возникают сразу после травмы, носят поверхностный характер (кожа и слизистые) и достаточно легко останавливаются с помощью прижатия. При осмотре выявляют небольшие точечные кровоизлияния из капилляров дермы (пе-техии). При нарушении функции тромбоцитов, кроме того, выявляют кровоизлияния в подкожные ткани (экхимозы, кровоподтеки), источником которых являются артериолы и венулы малого калибра. Напротив, при нарушениях вторичного гемостаза кровотечения развиваются спустя некоторое время после травмы, локализуются в глубоколежащих тканях (подкожная клетчатка, суставы, полости тела, мышцы) и прижатием останавливаются со значительными затруднениями. При поверхностном расположении кровоизлияние можно пропаль-пировать (гематомы в подкожной клетчатке), а при глубоком оно может оставаться нераспознанным (забрюшинное пространство).
Список литературы
Brown BR: Anesthesia in Hepatic and Biliary Tract
Disease. Davis, 1988. Hawker F: The Liver. Saunders, 1993. Isselbacher KJ et al 9 (editors): Harrison's Principles
of Internal Madicine, 13th ed. McGraw-Hill, 1994. Williams WJ et al: Hematology, 4th ed. McGraw- Hill,
1990.
Глава 35
Дата добавления: 2016-03-30; просмотров: 1390;
