Хімічні перетворення забруднень у атмосфері
Забруднюючі речовини поступають в атмосферу головним чином від природних джерел і внаслідок діяльності людини. Інколи це називають первинним забрудненням, на відміну від вторинного забруднення, причиною якого є хімічні зміни речовин в атмосфері. Забруднюючі речовини після виходу з джерела не залишаються в атмосфері в незмінному вигляді. Відбуваються фізичні зміни, особливо в процесі динамічних явищ, таких як переміщення і поширення в просторі, турбулентна дифузія, розбавлення і так далі. Крім того, в результаті хімічних процесів в атмосфері також відбуваються зміни. Часто це лише прості швидкі хімічні реакції (наприклад, окислення), температурні зміни, які приводять до конденсації деяких газів і пари, що супроводиться утворенням туманів, крапель і так далі. Після тривалого перебування деяких газоподібних забруднюючих речовин в атмосфері вони перетворюються на тверді, надзвичайно тонко-дисперсні частки. Наприклад, в результаті реакції кислих газів із пилом лугів утворюється тонко дисперсний пил різних солей.
Сонячне випромінювання викликає в атмосфері хімічні реакції між різними забруднюючими речовинами і киснем повітря. Найбільш часто в атмосфері проходить хімічний процес окислення речовин киснем повітря: окислення диоксиду сірки в триоксид, оксиду азоту в диоксид:
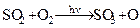 (5.1)
(5.1)
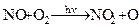 (5.2)
(5.2)
Аналогічним чином окислюються багато органічних речовин, наприклад альдегіди до органічних кислот, ненасичені вуглеводні і безліч інших речовин:
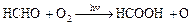 (5.3)
(5.3)
Швидкість окислення неоднакова для різних речовин і залежить від ряду додаткових чинників. Наприклад, унаслідок дуже швидкого окислення оксиду азоту киснем повітря рудий «хвіст» диоксиду азоту з'являється безпосередньо на виході оксиду азоту з димаря виробництва азотної кислоти. У сухому чистому повітрі диоксид сірки зберігається протягом 2-4 або більше днів, перш ніж повністю перетвориться на триоксид. Окрім вологості і наявності суспендованих твердих часток прискорити реакції окислення можуть такі чинники як ультрафіолетове випромінювання, а також наявність сильних оксидантів або їх вторинне формування. До цих речовин відносять озон, пероксиди і атомарний кисень, які утворюються в ході багатьох фотохімічних реакцій. Сонячне світло з довжиною хвилі в діапазоні 290-700 нм є фотохімічно ефективним, а речовини, що поглинають таке випромінювання, можуть діяти, як фоточутливі датчики, які переносять поглинену енергію до молекул речовин, здатних зазнавати вказані перетворення. В число первинних речовин, що поглинають ультрафіолетове випромінювання, входять сірка, диоксид азоту і альдегіди. Це випромінювання збуджує молекули вказаних речовин, які потім реагують з молекулярним киснем атмосфери з утворенням атомарного кисню. Атомарний кисень може також утворитися по реакціях:
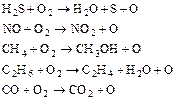 (5.4)
(5.4)
Реакції за участю диоксиду сірки і альдегідів протікають необоротньо. В той же час кількість атомарного кисню, що утворюється при цьому, відносно невелика, що відповідає вмісту диоксиду сірки і альдегідів в атмосфері. Проте при реакціях, в яких бере участь диоксид азоту, поглинання ультрафіолетового випромінювання приводить до розриву одного зв'язку між атомами азоту і кисню і утворення молекулярного кисню і оксиду азоту. Подальші реакції приводять до утворення молекулярного кисню і озону і регенерації диоксиду азоту. Ці процеси можна представити у вигляді:
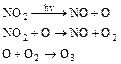 (5.5)
(5.5)
Регенерований диоксид азоту може знов вступити в реакцію, і, таким чином, цей процес може багато разів повторюватися до тих пір, поки диоксид азоту не перетвориться на азотну кислоту або не прореагує з органічними речовинами з утворенням нітросполук. Отже, навіть малі концентрації диоксиду азоту в атмосфері можуть з'явитися причиною утворення значних кількостей атомарного кисню і озону.
Кислотні дощі - це продукт взаємодії оксидів сірки, азоту і інших з'єднань з водяними парами атмосфери, які випадають на землю у вигляді кислотних опадів з дощами, снігом і туманами:
SO3 + H2O → H2SO4 (5.6)
2NO2 + H2O → HNO3 + HNO2 (5.7)
Смог – такий стан атмосфери, коли видимість знижена, а рівень забруднень від промислових викидів, вихлопних газів автомобілів і продуктів їх реакцій вельми високий. Існує два основні типи смогiв: відновний і окислювальний. Відновний cмог – це атмосферне явище, що зустрічається у великих промислових містах і є сумішшю диму, сажі, і диоксиду сірки. Зазвичай він досягає максимальних рівнів рано вранці, при температурі близько 0 0С і високій вологості і допов-нюється поляганням інверсії в атмосфері (відбивна або поверхнева інверсія). Фотохімічний окислювальний смог досягає максимального рівня біля полудня, при температурах 24-32 0С і низькій вологості і доповнюється низхідною інверсією. Основною умовою формування такого смогу є наявність в атмосфері оксидів азоту.

Рисунок 5.2 - Смог над Лос-Анджелесом у другій половині дня
Під дією ультрафіолетового випромінювання Сонця оксиди азоту і вуглеводні вступають між собою у фотохімічні реакції і утворюють агресивний фотохімічний смог (рисунок 5.2), такий, що містить озон і інші сильні окислювачі – пероксиацетілнітрати (ПАН), альдегіди, кетон і інші шкідливі речовини, що характеризуються дратівливою (очі, верхні дихальні путі) і алергічною дією.
Фотохімічне розкладання диоксиду азоту і інші вказані вище реакції ініціюють серію подальших реакцій, в яких беруть участь як неорганічні (переважно диоксид сірки), так і органічні (переважно вуглеводні) речовини, присутні в атмосфері. Вельми обширний набір кінцевих продуктів включає озон, формальдегід, акролеїн, органічні озоніди і органічні кислоти. Дуже важливими в процесі утворення окислювального смогу є також реакції ненасичених вуглеводнів з озоном. Найбільший вклад в його формування вносять ненасичені вуглеводні з п'яти - і шести вуглецевими ланцюжками (1-пентен, 1-гексен). Ненасичені вуглеводні з семи - і дев'яти вуглецевими ланцюжками також приводять до утворення озонідів і інших продуктів. Зустрічаються і вельми складні реакції з утворенням додаткових з'єднань в якості проміжних продуктів, а також з появою вільних радикалів у міру розкладання цих продуктів. При фотохімічних реакціях альдегідів і кетонів теж можуть утворюватися вільні радикали. Наприклад, форміл ( 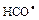 ) утворюється з формальдегіду, а метил і ацетил з ацетону (
) утворюється з формальдегіду, а метил і ацетил з ацетону ( 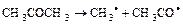 ). За цими реакціями можуть прослідувати інші із здобуттям всіляких продуктів. В повітрі вільні радикали швидко реагують з киснем з утворенням пероксидiв і органічних кислот. Таким чином, з ацетальдегіду утворюється диацетілпероксид, а з ацетону – диметілпероксид і оцтова кислота. Олефіни з великою кількістю подвійних зв'язків також вступають у фотохімічних реакції з появою вільних радикалів. При взаємодії з киснем деякі вільні радикали можуть утворити пероксид з'єднання, з яких виділяються нові пероксиди або вільні радикали, здатні викликати полімеризацію олефінiв або стати джерелом озону.
). За цими реакціями можуть прослідувати інші із здобуттям всіляких продуктів. В повітрі вільні радикали швидко реагують з киснем з утворенням пероксидiв і органічних кислот. Таким чином, з ацетальдегіду утворюється диацетілпероксид, а з ацетону – диметілпероксид і оцтова кислота. Олефіни з великою кількістю подвійних зв'язків також вступають у фотохімічних реакції з появою вільних радикалів. При взаємодії з киснем деякі вільні радикали можуть утворити пероксид з'єднання, з яких виділяються нові пероксиди або вільні радикали, здатні викликати полімеризацію олефінiв або стати джерелом озону.
Головну роль у виснаженні озонного шару грають хлорфторуглеродні з'єднання, хоча беруть участь і такі домішки, як диоксид вуглецю, метан, оксиди азоту. Монооксид азоту присутній в стратосферному шарі як обов'язковий його компонент, але в невеликій концентрації. Проте безперечним лідером в руйнуванні озонного шару вважається хлор. Молекула хлору здатна знищити до ста тисяч молекул озону, тоді як молекула оксиду азоту – близько 10 молекул озону. Хлорфторуглеродні з'єднання потрапляючи без змін в стратосферу і піддаються там дії ультрафіолетового випромінювання Сонця, розпадаються з вивільненням атомів хлору, які і руйнують молекули озону:
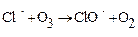 (5.8)
(5.8)
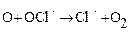 (5.9)
(5.9)
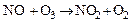 (5.10)
(5.10)
Дата добавления: 2016-03-27; просмотров: 1954;
