Принцип действия полярографических преобразователей
Полярографические преобразователи относятся также к типу электрохимических преобразователей. Прохождение электрического тока через электролиты сопровождается электролизом – химическими превращениями и выделением вещества из раствора. Прохождение через электролит любого сколь угодно малого количества электричества всегда сопровождается выделением на одном электроде и растворением на другом электроде соответствующего, совершенно определенного количества вещества. В результате этого концентрация ионов вблизи электродов оказывается иной, чем в остальном растворе. Неравные концентрации стремятся к выравниванию, но скорость диффузии ограничена и поэтому чем больше плотность тока на электроде, тем больше разница концентраций. Явление поляризации заключается в изменении электродных потенциалов, вследствие изменения при электродной концентрации в результате протекания через электролитическую ячейку электрического тока от внешнего источника. Потенциал, при котором в процессе электролиза выступает основная масса ионов данного вида, называется потенциалом выделения данного иона. Потенциалы выделения различны для всех ионов. На этом явлении основан так называемый поляризационный или полярографический метод качественного и количественного химического анализа растворов.
Полярографический преобразователь (рис.4.68) представляет собой электролитическую ячейку, заполненную анализируемым раствором с двумя электродами, к которым подводится напряжение от внешнего источника питания.
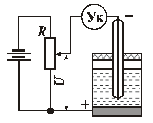
Рис. 4.68. Полярографический преобразователь.
Ток, проходящий через ячейку,
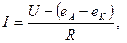 (4.33)
(4.33)
где R- сопротивление ячейки, берется не более 1000 Ом; eA - потенциал анода;
еK - потенциал катода; I - ток через ячейку выбирается равным 10-6 А.
Для того, чтобы поляризация происходила только на одном электроде, площадь поляризующегося электрода выбирается в несколько сот раз меньше площади другого электрода. Полагая потенциал неполяризующегося электрода еA близким к 0, а падение напряжения IR исчезающе малым по сравнению с величиной приложенного напряжения U, можно определить потенциалы eK для разных токов как еK» -U). Полученная таким образом вольтамперная характеристика (полярограмма) преобразователя представлена на рис. 4.69.
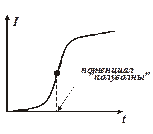
Рис. 4.69. ВАХ полярографического преобразователя.
На рис.4.70 показаны полярограммы восстановления одних и тех же ионов, полученные при различной концентрации их в растворе.
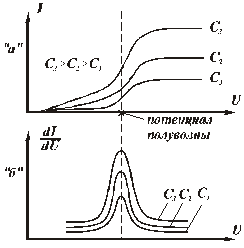
Рис. 4.70. Полярограммы восстановления ионов при различной концентрации растворов.
Как видно из кривых, потенциал выделения ионов при прочих равных условиях зависит от концентрации. Поэтому для качественного анализа используют не потенциал начала резкого возрастания тока (так называемой «волны» тока на графике), а потенциал, соответствующий середине этой волны, — потенциал «полуволны», который не зависит от концентрации ионов и параметров преобразователя. Если графически продифференцировать полярографические кривые I=f(U), то максимумы кривых dI/dU=f (U) (рис.4.70) будут при одном и том же потенциале, соответствующем потенциалу полуволны исследуемых ионов, а высоты максимумов будут пропорциональны концентрациям. Если в исследуемом растворе содержатся ионы нескольких видов (например, Pb++, Cd++, Zn++), каждый вид ионов дает свой прирост тока - свою «волну», в результате получается многоступенчатая полярограмма (рис.4.71).
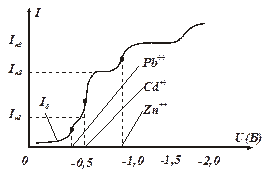
Рис. 4.71. Многоступенчатая полярограмма.
При подаче на преобразователь возрастающего напряжения в начале через него идет только остаточный ток I0, обусловленный разрядом небольшого числа ионов всех видов. При достижении напряжением потенциала разряда ионов Рb++ (—0,45 В) ток через преобразователь резко возрастает и достигает значения IП1 определяемого концентрацией ионов Рb++ в растворе. При дальнейшем росте напряжения ток остается равным IП1, до тех пор, пока не будет достигнут потенциал разряда ионов Cd++ (0,6 В). После чего ток резко возрастает до значения IП2.
При этом разность токов IП2 — IП1 соответствует концентрации в растворе ионов Cd++. При достижении напряжением потенциала разрядов ионов Zn++ (—1,0 В) произойдет следующий скачок и т. д. Потенциалы полуволн различных элементов образуют так называемый полярографический спектр, и их значения приведены в специальных таблицах.
Сравнивая потенциалы полуволн, полученные при исследовании неизвестного раствора, с табличными данными, можно установить химический состав исследуемого раствора. Все значения потенциалов полуволн в таблицах даются относительно потенциала нормального каломельного полуэлемента.
Дата добавления: 2016-03-22; просмотров: 1174;
