Описание и растворимость. Раствор водорода пероксида – бесцветная прозрачная жидкость без запаха слабокислой реакции среды.
Раствор водорода пероксида – бесцветная прозрачная жидкость без запаха слабокислой реакции среды.
Магния пероксид – белый порошок без запаха. Практически нерастворим в воде, растворим в разведенных минеральных кислотах и кипящей кислоте уксусной разведенной с выделением водорода пероксида:
МgO2 + MgO + 2H2SO4 → 2MgSO4 + H2O2 + H2O
Гидроперит – белый кристаллический порошок. Легко растворим в воде, растворим в этаноле.
Подлинность
1. Общая реакция – реакция образования надхромовых кислот. Основана на окислительных свойствах водорода пероксида. Калия дихромат в кислой среде окисляется водорода пероксидом до перекисных соединений. Образуются надхромовая кислота и хрома пентаоксид, неустойчивые в водной среде. Продукты окисления извлекают в слой эфира, который окрашивается в синий цвет.
K2Cr2O7 + H2SO4 H2Cr2O7 + K2SO4
Двухромовая кислота
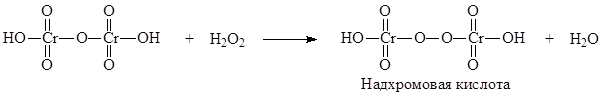
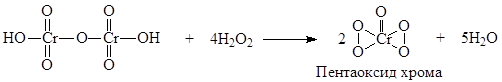
Магния пероксид для проведения этой реакции растворяют в кислоте серной разведенной.
2. Специфические реакции.
2.1. Магния пероксид. Доказывают катион магния (после растворения ЛВ в кислоте серной разведенной) по реакции осаждения с натрия гидрофосфатом в присутствии аммония гидроксида и аммония хлорида:
NH4Cl
MgSO4 + Na2HPO4 + NH4OH → MgNH4PO4↓ + Na2SO4 + H2O
Образуется белый кристаллический осадок магния аммония фосфата, растворимый в разведенных минеральных кислотах и в кислоте уксусной.
2.2. Гидроперит.Доказывают присутствие мочевины биуретовой реакцией. При медленном нагревании мочевины до 150-160 0С образуется биурет, который в щелочной среде с солями меди (II) образует комплексные соединения, окрашенные в фиолетовый цвет:
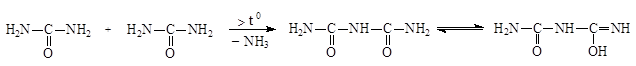
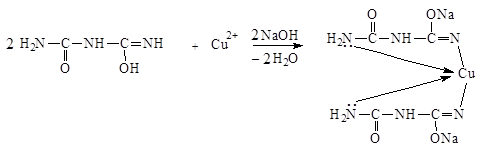
Фиолетовое окрашивание
Чистота
У раствора водорода пероксида определяют рН потенциометрическим методом (рН должно быть 3,8-5,6).
В магния пероксиде и гидроперите определяют:
1. Допустимые общие примеси – хлориды, сульфаты, кальций, железо.
2. Потерю в массе при высушивании.
Дата добавления: 2016-03-20; просмотров: 2801;
