Вода для инъекций Aqua pro injectionibus
Воду для инъекций получают дистилляцией или обратным осмосом и применяют в качестве растворителя для приготовления инъекционных лекарственных средств, глазных капель.
Вода для инъекций должна выдерживать испытания, приведенные в ФС «Вода очищенная», а также должна быть апирогенной, не содержать антимикробных веществ и других добавок.
Определение пирогенности проводят в соответствии со статьей ГФ ХI «Испытание на пирогенность» на кроликах.
Воду для инъекций используют свежеприготовленной или хранят не более 24 часов при температуре 5-10 0С или 80-95 0С в закрытых емкостях, изготовленных из материалов, не изменяющих свойств воды, защищающих от попадания механических включений и микробиологических загрязнений.
Анализ воды очищенной и воды для инъекций в условиях аптек
В аптеках согласно приказу № 214 от 16 июля 1997 года вода очищенная ежедневно (из каждого баллона, а при подаче воды по трубопроводу на каждом рабочем месте) проверяется на отсутствие хлоридов, сульфатов и солей кальция. Вода для инъекций, кроме указанных выше испытаний, должна быть проверена на восстанавливающие вещества, аммиак и диоксид углерода.
Ежеквартально вода очищенная должна направляться в территориальную контрольно-аналитическую лабораторию для полного химического анализа.
СОЕДИНЕНИЯ СЕРЫ
Натрия тиосульфат Sodium thiosulfate (МНН)
Na2S2O3 • 5 H2O Natrii thiosulfas (ЛН)
Натриевая соль тиосерной кислоты
Структурная формула:
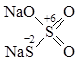
Атомы серы имеют различную степень окисления. За счет S2 ЛВ проявляют восстановительные свойства.
Получение
1. При нагревании натрия сульфита и серы:
Na2SO3 + S → Na2S2O3
2. Окислением натрия сульфида диоксидом серы:
2Na2S + 3SO2 → 2Na2S2O3 + S↓
Описание и растворимость
Бесцветные прозрачные кристаллы без запаха. В теплом сухом воздухе теряет кристаллизационную воду (выветривается). Во влажном воздухе расплывается (переходит в жидкое состояние). При температуре
+50 0С плавится в кристаллизационной воде.
Очень легко растворим в воде, практически нерастворим в спирте.
Подлинность
1. Реакции на ион натрия (см. с. 24).
2. Реакции на тиосульфат-ион:
2.1. Реакция с раствором серебра нитрата.
Сначала образуется белый осадок серебра тиосульфата:
Na2S2O3 + 2AgNO3 → Ag2S2O3↓ + 2NaNO3
Серебра тиосульфат быстро разлагается (внутримолекулярная окислительно-восстановительная реакция), образуются серебра сульфит и сера (желтый осадок):
Ag2S2O3 → Ag2SO3↓ + S↓
При стоянии образуется черный осадок серебра сульфида:
Ag2SO3 + S + H2O → Ag2S↓ + H2SO4
2.2. Реакция разложения с кислотой хлороводородной разведенной:
Na2S2O3 + 2HCl → 2NaCl + SO2↑ + S↓+ H2O
Выделяются диоксид серы (обнаруживается по специфическому запаху) и свободная сера (помутнение раствора).
Чистота
1. Прозрачность и цветность 30% раствора – должен быть прозрачным и бесцветным.
2. Предельное содержание общих примесей: хлоридов, тяжелых металлов, железа, кальция.
3. Сульфиды (недопустимая примесь) обнаруживают реакцией с натрия нитропруссидом в присутствии раствора аммиака. Не должно быть фиолетового окрашивания:
Na2S + Na2[Fe(CN)5NO] → Na4[Fe(CN)5NOS]
Фиолетовое окрашивание
4. Сульфиты, сульфаты (недопустимые примеси). Для обнаружения сульфитов добавляют раствор йода:
SO32 + I2 + H2O → SO42 + 2HI
Полученный раствор не должен иметь кислую реакцию среды (не должно образовываться HI).
Для обнаружения сульфатов к полученному раствору добавляют раствор бария нитрата – не должно быть помутнения.
Дата добавления: 2016-03-20; просмотров: 3800;
