Приложение 3. Исследования морфофункциональных особенностей биологических объектов при помощи электронной микроскопии
***
С использованием световой и просвечивающей электронной микроскопии выполнено исследование по изучению дегрануляции тучных клеток кожи под действием низкоинтенсивного электромагнитного излучения крайне высокой частоты. Эксперименты были проведены на крысах-самцах линии Вистар массой 100-120 г. За 30 мин до начала эксперимента животных анестезировали подкожным введением 100 мг/кг веронала. В качестве источника ЭМИ КВЧ использован генератор Г4-141. Стабильность частоты генератора составляла ± 0,05%, частоты выходного сигнала в режиме непрерывной генерации была не более 6 МГц. Частота выходного сигнала контролировалась волномером. В опытной группе облучали кожу внутренней поверхности кисти правой лапы крысы в течение 20 мин, частота излучения составляла 42,0 ГГц плотность потока энергии излучения – составляла 50 мкВт/см2. Крысы контрольной группы помещались на 20 мин в зону облучения при отсутствии энергии на выходе излучателя. Через 15 мин после процедур облучения или имитации облучения бралась биопсия участка облученной кожи животного в проекции точки акупунктуры. Образцы кожи размером 2x2 мм иссекали до подкожной фасции и фиксировали в растворе 3% параформальдегида и 2,5% глутарового альдегида в течение 2-4 ч с последующей фиксацией в 1% растворе четырехокиси осмия (2-12 ч). Фиксаторы готовили на 0,1 М Na-какодилатном буфере (рН 7,2-7,4) Далее образцы обезвоживали в серии возрастающего по концентрации этанола и в 100% ацетоне. Затем образцы полимеризовали при 70°С в смеси эпоксидных смол эпон 812 / аралдит М. После полимеризации из всех образцов готовили серийные полутонкие срезы (толщиной 2 мкм) на ультрамикротоме Reichert (Австрия) с помощью стеклянных ножей. Срезы окрашивали метиленовым синим/азуром II и основным фуксином. Морфологический анализ проводился на световом микроскопе. Ультратонкие срезы толщиной 70-90 нм готовили на том же ультрамикротоме, окрашивали уранилацетатом и цитратом свинца стандартным способом и исследовали в электронном микроскопе JEOL 100В (Япония) при ускоряющем напряжении 80 кВ.
В результате анализа гистологических препаратов (по видимой плотности гранул на профиль тучной клетки) было установлено, что после действия низкоинтенсивного ЭМИ КВЧ с частотой 42,0 ГГц наблюдалась дегрануляция тучных клеток.
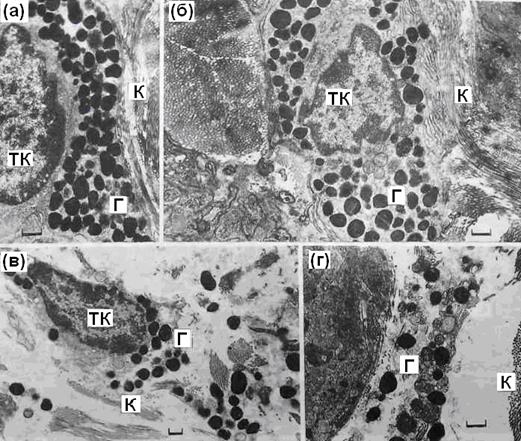
Рис. 44. Ультраструктура тучных клеток (ТК) в контроле (а,б) и после облучения ЭМИ КВЧ (в,г). Видно в контроле гранулы (Г) плотно упакованы в цитоплазме тучных клеток плазматическая мембрана которых имеет многочисленные цитоплазматические выросты (б). После облучения (в,г) происходит дегрануляция ТК с выбросом гранул в экстраклеточное пространство и исчезновение цитоплазматических выростов на плазматической мембране (в).

Рис. 45. Ультраструктура тучных клеток (ТК) в контроле и после облучения ЭМИ КВЧ. После облучения не обнаружено нарушений в ультраструктуре капсулированных нервных окончаний (НО) как на уровне эндотелия (Эн) и швановских клеток (ШК), так и в структуре образуемых ими миелиновых (М) оболочек (д,е), окружающих, в частности, аксоны (А). К – коллагеновые фибриллы. Шкала - 1 мкм.
Качественный анализ был проведен на ультратонких срезах. После облучения происходит дегрануляция ТК с выбросом гранул в экстраклеточное пространство. Важной особенностью тучных клеток после действия ЭМИ КВЧ является наличие в них более крупных гранул с относительно низкой электронной плотностью. Изменений в структуре миелина инкапсулированных нервных окончаний выявлено не было.
Таким образом, исходя из полученных результатов следует, что дегрануляция тучных клеток in vivo может быть использована как относительно простой критерий для оценки эффекта излучения даже при условии нетепловых интенсивностей ЭМИ КВЧ. Можно также предположить, что реакция тучных клеток кожи может быть важным усилительным механизмом в цепочке событий, ведущих к системному отклику организма на воздействие низкоинтенсивного электромагнитного излучения.
***
Применяя электронную микроскопию можно изучать взаимодействие биологических объектов на разных уровнях организации. Так, было показано, что тимопентин (ПЕП33) и синтезированный С-концевой пептид тимусного гормона тимопоэтина, формирует пучки нитей Ф-актина в присутствии 0,1 М KCl.
В исследовании был использован актин скелетных мышц кролика, а так же фрагменты гормона тимопоэтина - пентапептид Арг-Лиз-Асп-Вал-Тир (тимопентин, ПЕП5) и С-концевой полипептид (ПЕП33), которые обладают иммунорегуляторной активностью исходного полипептида тимопоэтина. Г-актин и Ф-актин (0,2 мг/мл) был инкубирован при комнатной температуре с разными концентрациями пептидов (0,4 – 1 мг/мл), затем разбавлен Г-актиновым или Ф-актиновым буферами. Конечная концентрация актина составляла 0,1 мг/мл при весовом соотношении актин : ПЕП – 1 : 1. Для электронно-микроскопических исследований капли образцов актина и пептида наносили на медные сеточки, покрытые напыленным углем коллодиевыми пленками, и окрашенные 1% водным раствором уранилацетата. Образцы исследовались на электронном микроскопе JEOL JEM 1200 EX при ускоряющем напряжении 80 кВ и с объективной апертурой 50 мкм.

Рис.46. Электронная микрофотография негативно окрашенных пучков актиновых нитей, образуемых ПЕП33. В пучках видны продолговатые агрегаты ПЕП33 (стрелки). Негативное окрашивание 1% водным раствором уранилацетатом. Шкала 200 нм.
Анализ микрофотографий показал, что в присутствии 0,1 М KCl Ф-актин или Г-актин при добавлении ПЕП33 формируют пучки актиновых нитей. Пучки образуются в результате связывания агрегатов ПЕП33 с нитями актина. Более слабый пучкующий эффект был обнаружен для ПЕП5: образующиеся пучки актиновых нитей небольших размеров. В отсутствие KCl не было выявлено изменений в структуре Г-актина при добавлении ПЕП33, а при его добавлении образуются небольшие пучки.
Таким образом установлено, что ПЕП33 связывается с Ф-актином, но не с Г-актином. Изменение агрегационного состояния нитей актина в мышцах должно приводить к нарушению их сократительной и двигательной функции. Обнаруженное свойство фрагментов тимопоэтина, систематическое освобождение которого из тимуса регистрируется при серьезном нервно-мышечном заболевании Myasthenia gravis, напротив, приводит к пучкованию актиновых нитей в клетке, способствуя ускорению дегенеративных процессов в саркомерах. Важный симптом развития этой болезни — прогрессирующее снижение мышечной силы.
***
Методами растровой электронной микроскопии (HITACHI-405 A) и спиновых зондов проведены исследования по изучению емкости эритроцитарной мембраны для органических неэлектролитов из разных групп химических соединений. В качестве объектов для исследования в экспериментах с гидрофобными спин-мечеными неэлектролитами мембранами использовали эритроциты, полученные из венозной крови взрослых самцов белых крыс. Объектом исследования в экспериментах с синтетическим антиоксидантом служили эритроциты человека, выделенные из венозной крови здоровых доноров по общепринятым методикам. В качестве неэлектролитов использованы гидрофобные спин-меченые производные γ-карболина и стеариновой кислоты, а также экранированный фенольный антиоксидант фенозан-1. Образцы для РЭМ напылялись слоем платины в вокумной установке EICO IB-3.
На основании анализа спектров электронного парамагнитного резонанса гидрофобных спин-меченых неэлектролитов и электронных микрофотографий эритроцитов выявлены различия в емкости областей распределения во внутримембранном пространстве производного γ-карболина и фенозана-1, с одной стороны, и спин-меченого производного жирной кислоты с другой.
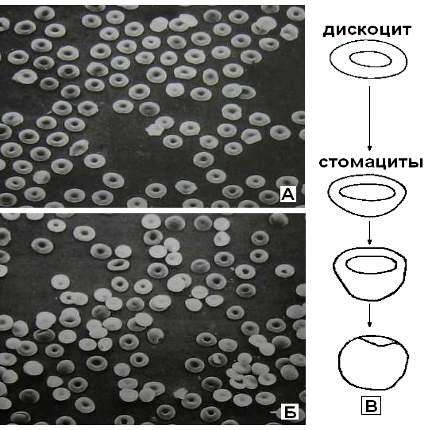
Рис.47. Эритроциты человека: (А) – контроль; (Б) – в присутствии фенозана-1 (7·10-4 М); x l000. Суспензия эритроцитов содержала 6,2-106 клеток/мкл; (В) – схема трансформации эритроцитов.
В результатов анализа результатов опытов с гидрофобных спин-меченых неэлектролитов (ГСН) позволили сделать предположение, что ограниченная емкость мембраны для вещества-неэлектролита и наличие нескольких областей его распределения в мембране могут определенным образом проявиться в чувствительной к мембранному транспорту ксенобиотиков морфологии эритроцитов. Для подтверждения этих предположений были проведены исследования с использованием сканирующей растровой электронной микроскопии. В качестве органического неэлектролита использован синтетический фенольный антиоксидант фенозан -1 (Ф 1 – в концентрации 10 -5 – 10-3 М). При увеличении концентрации дискоциты трансформируются в различные формы стомацитов, что свидетельствуют о встраивании Ф 1 в клеточную мембрану.
Полученные данные указывают на то, что антиоксидантное действие Ф 1, в зависимости от его концентрации, может реализовываться во внешнем и/или внутреннем монослоях мембраны эритроцита. Характер распределения определяется, с одной стороны, структурой антиоксиданта, с другой таким важным свойством мембраны, как ограниченная емкость для вещества гидрофобного неэлектролита ее областей распределения.
Таким образом, характер распределения ксенобиотиков в мембране эритроцита может оказывать влияние на форму клеток, а такие нарушения могут существенно изменить функциональная активность эритроцитов.
Дата добавления: 2016-02-10; просмотров: 1761;
