Биологическая роль КТ
КТ — хорошие топливные молекулы, окисление β-гидроксибутирата до СО2 и Н2О обеспечивает быстрый синтез 26 молекул АТФ. Окисление КТ, как и ЖК сберегает глюкозу, что имеет большое значение в энергоснабжении аэробных тканей при длительном голодании и физических нагрузках, когда возникает дефицит глюкозы. Для нервной ткани КТ имеют исключительное значение, так как в отличие от мышц и почек, нервная ткань практически не использует ЖК в качестве источника энергии, так как ЖК не проходят гематоэнцефалический барьер.
Преимущество КТ перед ЖК: 1) КТ водорастворимы, а ЖК – нет; 2) ЖК разобщают окислительное фосфорилирование и усиливают синтез ТГ, а КТ – нет.
Ацетон, в отличие от β-оксибутирата и ацетоацетата, не утилизируется тканями. Он выделяется с выдыхаемым воздухом, мочой и потом, что позволяет организму избавляться от избытка КТ, которые не успели вовремя окисляться.
Кетоацидоз
В норме концентрация КТ в крови составляет 1—3 мг/дл (до 0,2 мМ/л), но при голодании значительно увеличивается. Увеличение концентрации КТ в крови называют кетонемией. При кетонемии развивается кетонурия - выделение КТ с мочой. Накопление КТ в организме приводит к кетоацидозу, так как КТ (кроме ацетона) являются водорастворимыми органическими кислотами (рК~3,5).
Ацидоз достигает опасных величин при сахарном диабете, так как концентрация КТ при этом заболевании может доходить до 400—500 мг/дл. Тяжёлая форма ацидоза — одна из основных причин смерти при сахарном диабете.
ХОЛЕСТЕРИН
Холестерин (ХС) — стероид, характерный только для животных организмов.
Источником ХС в организме являются синтетические процессы и пища. В сутки в организме синтезируется около 1г (0.7) ХС. В печени синтезируется более 50% ХС, в тонком кишечнике — 15— 20%, остальной ХС синтезируется в коже, коре надпочечников, половых железах. С пищей поступает в сутки 0,3—0,5г (0.3-0.4) ХС. Общее содержание ХС в организме составляет в среднем 140г, 90-93% находиться в клетках, 7-10% - в крови (5,2+1,3 ммоль/л).
Биологическая роль ХС
1. ХС входит в состав всех мембран клеток, увеличивает их электроизоляционные свойства, придает им жесткость и прочность;
2. В мембране ХС защищает полиненасыщенные ЖК от окисления;
3. из ХС синтезируются жёлчные кислоты (0,5-0,7 г ХС в сут) 0.45, стероидных гормоны (половые и кортикоиды) (40 мг ХС в сут) и витамин Д3 (10 мг ХС в сут).
4. ХС является компонентом желчи.
Обмен ХС чрезвычайно сложен, в нем участвует около 300 разных белков.
Синтез ХС
Реакции синтеза ХС происходят в цитозоле и ЭПР клеток. Это один из самых длинных метаболических путей в организме человека (около 100 последовательных реакций).
Синтез ХС делят на 3 этапа:
I этап синтеза ХС - образование мевалоната (мевалоновой кислоты).
1. Две молекулы ацетил-КоА конденсируются тиолазой с образованием ацетоацетил-КоА;
2. Гидроксиметилглутарил-КоА-синтаза присоединяет третий ацетильный остаток к ацетоацетил-КоА с образованием ГМГ-КоА (3-гидрокси-3-метилглутарил-КоА). Эта последовательность реакций сходна с начальными стадиями синтеза КТ. Однако синтез КТ происходит в митохондриях печени, а реакции синтеза ХС — в цитозоле клеток.
3. ГМГ-КоА-редуктаза восстанавливает ГМГ-КоА до мевалоната с использованием 2 молекул НАДФH2. Фермент ГМГ-КоА-редуктаза — гликопротеин, пронизывающий мембрану ЭПР, активный центр которого выступает в цитозоль.
II этап синтеза ХС - образование сквалена
1. Мевалонат превращается в изопреноидную структуру — изопентенилпирофосфат (5 атомов С);
2. 2 изопентенилпирофосфата конденсируются в геранилпирофосфат (10 атомов С);
3. Присоединение изопентенилпирофосфата к геранилпирофосфату дает фарнезилпирофосфат (15 атомов С).
4. 2 фарнезилпирофосфата конденсируются в сквален (15 атомов С).
III этап синтеза ХС - образование ХС
Сквален циклазой превращается в ланостерол, (4 цикла и 30 атомов С).
Далее происходит 20 последовательных реакций, превращающих ланостерол в ХС (27 атомов С).
В организме человека изопентенилпирофосфат также служит предшественником убихинона (KoQ) и долихола, участвующего в синтезе гликопротеинов.
Регуляция синтеза ХС
Ключевой фермент синтеза ХС ГМГ-КоА-редуктазы регулируется несколькими способами:
· ХС, желчные кислоты (в печени) репрессируют ген ГМГ-КоА-редуктазы. В норме поступление ХС с пищей снижает синтез собственного ХС в печени, однако с возрастом эффективность этой регуляции у многих людей снижается и уровень ХС повышается.
· Инсулин через дефосфорилирование осуществляет активацию ГМГ-КоА-редуктазы.
· Глюкагон через фосфорилирование осуществляет ингибирование ГМГ-КоА-редуктазы.
Повышение концентрации исходного субстрата ацетил-КоА стимулирует синтез ХС.
Таким образом, синтез ХС активируется при питании углеводами и ингибируется при голодании.
Этерификация ХС
ХС образует с ЖК сложные эфиры (ЭХС), которые более гидрофобны чем сам ХС. В клетках эту реакцию катализирует АХАТ (ацилКоА: холестеролацилтрансферазой): ХС + АцилКоА → ЭХС + HSKoA
АХАТ содержится лишь в некоторых тканях, синтезированный им ЭХС формирует в цитоплазме липидные капли, которые являются формой хранения ХС. По мере необходимости ЭХС гидролизуются холестеролэстеразой на ХС и ЖК.
ЭХС синтезируются также в крови в ЛПВП под действием ЛХАТ (лецетин: холестеролацилтрансферазой): ХС + лецитин → ЭХС + лизолецитин
В составе ЛП ЭХС обеспечивают большую часть транспорта ХС в крови. На долю ЭХС крови приходиться 75% от общего количества ЭХС в организме.
Выведение ХС из организма
Так как производные циклопентанпергидрофенантрена (стероиды) водонерастворимы и в организме не расщепляются, они выводятся из организма в основном с калом в составе желчи и немного с потом через кожу.
В сутки из организма выводится от 1,0г до 1,3г ХС. ХС выводится с желчью (0,5-0,7 г/сут) в основном в виде жёлчных кислот и частично в чистом виде. Часть ХС в кишечнике под действием ферментов бактерий восстанавливается по двойной связи, образуя холестанол и копростанол. С кожным салом в сутки выделяется 0,1г ХС.
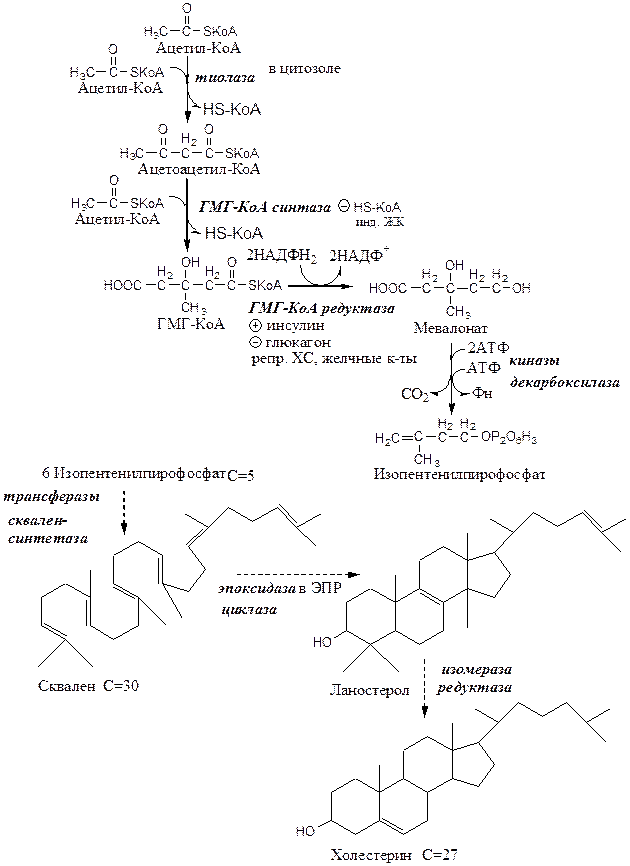
ГИПЕРХОЛЕСТЕРОЛЕМИЯ
Концентрация ХС в крови взрослых составляет 5,2+1,2 ммоль/л, как правило, с возрастом она увеличивается. Нарушения обмена ХС чаще всего проявляется гиперхолестеролемией, повышением ХС в крови выше нормы.
Причины развития гиперхолестеринемии:
1. Избыточного поступления с пищей ХС. Так как выведение из организма ХС ограничено 1,2—1,5 г/сут, излишки ХС накапливаются;
2. Переедание, недостаточная физическая активность, ожирение, сахарный диабет и гипотериоз способствуют гипергликемии и гиперлипидемии. Избыток углеводов и липидов в организме идет на повышенный синтез ХС;
3. Избыток в пище насыщенных и дефицит полиненасыщенных ЖК стимулирует в организме синтез ХС;
4. Некоторые дислипопротеинемии. Любой дефект рецептора ЛПНП (часто) или белка апоВ-100, взаимодействующего с ним, приводит к распространённому наследственному заболеванию — семейной гиперхолестеролемии. Она сопровождается ксантоматозом и атеросклерозом. У гомозигот с дефектом рецептора ЛПНП смерть в возрасте 5—6 лет от инфаркта или инсульта;
Коэффициент атерогенности = (ХСобщ –ХСЛПВП) / ХСЛПВП < 3
Гиперхолестеринемия вызывает атеросклероз и желчекаменную болезнь.
АТЕРОСКЛЕРОЗ
Атеросклероз – хроническое прогрессирующее заболевание крупных и средних эластических и мышечно-эластических артерий. Атеросклероз характеризуется пролиферативно-синтетическим ответом ряда клеток сосудистой стенки и крови – гладкомышечных макрофагов, тромбоцитов, фибробластов на патологические (качественно своеобразные или количественно избыточные) ЛП, с формированием в интиме фиброатером.
Причины развития атеросклероза:
1. Гиперхолестеринемия;
2. Гиперлипидемия ЛПОНП, ЛППП и ЛПНП (вызывают генетические дефекты рецепторов, апобелков, СД, гипотериоз, переедание).
3. Изменение нормальной структуры ЛПНП под действием ПОЛ и гипергликемии. Избыток глюкозы гликозилирует апобелки, повышенное ПОЛ (при гипоксии, воспалении) повреждает липиды и апобелки ЛП. Модифицированные ЛПНП становятся чужеродными для организма, атакуются антителами и поглощаются макрофагами с участием «скевенджер-рецепторов» (рецепторов-мусорщиков);
4. Повреждение сосудистой стенки высоким артериальным давлением (психоэмоциональные стрессы), ПОЛ (гипоксия, курение (через СО), воспаления), иммунными реакциями, токсинами и другими ядовитыми веществами (Pb, Cd). Повреждающие факторы разрыхляют и истончают (до исчезновения) гликокаликс энтероцитов, увеличивают межэндотелиальные щели, что создает на поверхности эндотелия зоны повышенной клейкости и проницаемости;
5. Принадлежность к мужскому полу (гормональный статус).
Молекулярные механизмы развития атеросклероза
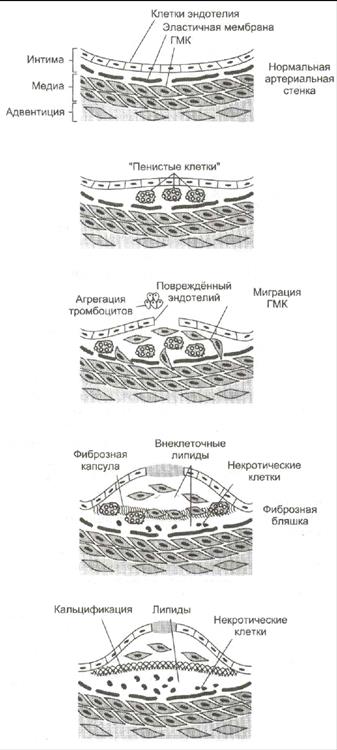
Развитие атеросклероза проходит в 6 стадий:
1. Стадия измененного эндотелия. На поверхности поврежденного эндотелия скапливаются тромбоциты и моноциты. Модифицированные ЛПНП проникают под поврежденный эндотелий сосудов. За ними направляются моноциты (в ткани они макрофаги) и захватывают ЛП через скевенджер-рецепторы. Этот процесс не ингибируется избытком ХС, поэтому макрофаги перегружаются ХС и превращаются в «пенистые клетки». Отдельные «пенистые клетки» есть у новорожденных.
2. Стадия жировых полосок. При увеличении количества «пенистых клеток» они образуют липидные полоски. «Пенистые» клетки адсорбируют все остальные липиды без разбора. Поврежденный эндотелий, активированные макрофаги, тромбоциты выделяют БАВ, которые стимулируют пролиферацию ГМК и миграцию их в очаг повреждения.
3. Стадия переходная. Активированные ГМК синтезируют коллаген и эластин, что приводит к прорастанию бляшки фиброзной тканью. Клетки под фиброзной оболочкой некротизируются, а ХС начинает откладываться в межклеточном пространстве. Может происходить разрыв эндотелия сосудов.
4. Стадия атеромы. ХС межклеточного пространства формирует в центре бляшки липидную каплю – атерому, которая через разрушенный эндотелий выступает в просвет сосуда.
5. Стадия фиброатеромы. Атерома пропитываясь солями кальция, белками, ГАГ и приобретает плотную фиброзную крышку. Атерома становиться фиброатеромой.
6. Стадия осложнения фиброатеромы. Фиброатерома не стабильна, она может надрываться и изъявляться, что приводит к обострению атеросклероза.
Осложнения. Поврежденный эндотелий прекращает синтез PGI2, который в норме ингибирует тромбоциты. Тромбоциты активируются и секретируют тромбоксан ТХА2 и тромбоцитарный фактор роста (пептид). Тромбоцитарный фактор роста привлекает в бляшку клетки крови, ГМК, что способствует росту бляшки и развитию очага воспаления. ТХА2 → агрегацию тромбоцитов → образование тромбов → закупорка сосудов → ишемия тканей → некроз тканей → изъявления стенок сосудов → кровотечения, аневризмы. Оторвавшиеся тромбы → эмболии сосудов.
Чаще всего атеросклероз развивается в коронарных, мозговых, почечных артериях, артериях нижних конечностей и в аорте. Атеросклероз коронарных артерий проявляется ИБС, мозговых – ИБ мозга, почек – вазоренальной артериальной гипертензией. Спазм или тромбоз коронарных сосудов ведет к инфаркту миокарда, эмболия сонных артерий ведет к развитию инсультов.
Смертность от последствий атеросклероза (инфаркт миокарда, инсульт) лидирует в общей структуре смертности населения.
Биохимические основы лечения атеросклероза
Лечение гиперхолестеролемии, как правило, комплексное.
I Диета. Необходимо употреблять:
1) продукты гипокалорийные, гипохолестериные, с низким содержанием легкоусвояемых углеводов (растительная пища). Поступление ХС с пищей не должно превышать 0,3 мг/сут;
2) полиеновые ЖК семейства ω-3 (морепродукты). Из них синтезируются простагландины, подавляющие тромбообразование и замедляют развитие атеросклеротической бляшки. Ненасыщенные ЖК также ускоряют выведение ХС из организма (механизм не ясен);
3) витамины С, Е, А и другие антиоксиданты ингибирующие ПОЛ и поддерживающие нормальную структуру ЛПНП и их метаболизм.
Липримал дает самый сильный эффект
II. «Размыкание» цикла энтерогепатической циркуляции жёлчных кислот. Лекарства типа холестирамина, холестипол (полимеры) адсорбируют в кишечнике жёлчные кислоты, выделяются с фекалиями и таким образом уменьшают возврат жёлчных кислот в печень. В печени увеличивается захват ХС из крови для синтеза новых жёлчных кислот.
III. Ингибирование синтеза ХС. Наиболее эффективные препараты для лечения атеросклероза — ингибиторы ГМГ-КоА-редуктазы, например антибиотик мевакор. Такие препараты могут почти полностью подавить синтез ХС в организме, нормализуя уровень ХС.
IV. Активация катаболизма ЛП. Лекарственные препараты — фибраты (клофибрат, фенофибрат) активируют ЛПЛ и ускоряют катаболизм ЛПОНП. Эти препараты также активируют окисление ЖК в печени, уменьшая тем самым синтез ТГ и ЭХС и, как следствие, секрецию ЛПОНП печенью.
Для эффективного лечения атеросклероза применяют, как правило, комбинированное воздействие нескольких лекарственных препаратов.
| |
ЖЕЛЧЕКАМЕННАЯ БОЛЕЗНЬ
Желчнокаменная болезнь — патологический процесс, при котором в жёлчном пузыре образуются камни, основу которых составляет ХС.
Выделение ХС в жёлчь должно сопровождаться пропорциональным выделением жёлчных кислот и фосфолипидов, удерживающих гидрофобные молекулы ХС в жёлчи в мицеллярном состоянии.
Если активность ГМГ-КоА-редуктазы повышена, а активность 7-а-гидроксилазы снижена - ХС синтезируется много, а жёлчных кислот мало. Это приводит к диспропорции ХС и жёлчных кислот, секретируемых в жёлчь. ХС начинает осаждаться в жёлчном пузыре, образуя вначале вязкий осадок, который постепенно становится более твёрдым. Иногда он пропитывается билирубином, белками и солями кальция. Камни, образующиеся в жёлчном пузыре, могут состоять только из ХС (холестериновые камни) или из смеси ХС, билирубина, белков и кальция.
Холестериновые камни обычно белого цвета, а смешанные камни — коричневого цвета разных оттенков.
Причин, приводящих к изменению соотношения жёлчных кислот и ХС, в жёлчи много: пища, богатая ХС, гиперкалорийное питание, застой жёлчи в жёлчном пузыре, нарушение энтерогепатической циркуляции, нарушения синтеза жёлчных кислот, инфекции жёлчного пузыря.
Если камни начинают перемещаться из жёлчного пузыря в жёлчные протоки, то они вызывают спазм жёлчного пузыря и протоков, что больной ощущает как приступ сильной боли. Если камень перекрывает проток некоторое время, то нарушается поступление жёлчи в кишечник, жёлчные пигменты проходят через мембраны гепатоцитов в сторону синусоидов и попадают в кровь, что приводит к развитию обтурационной (подпечёночной желтухи).
Лечение желчнокаменной болезни
В начальной стадии образования камней можно применять в качестве лекарства хенодезоксихолевую кислоту. Попадая в жёлчный пузырь, эта жёлчная кислота постепенно растворяет осадок ХС (холестериновые камни), однако это медленный процесс, требующий нескольких месяцев.
ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
Кафедра биохимии
Утверждаю
Зав. каф. проф., д.м.н.
Мещанинов В.Н.
_____‘’_____________2005 г
ЛЕКЦИЯ № 16
Тема: Уровни и механизмы регуляции обмена липидов. Ожирение.
Факультеты: лечебно-профилактический, медико-профилактический, педиатрический.
2 курс.
Дата добавления: 2016-02-13; просмотров: 652;
