ВЛИЯНИЕ ВРЕДНЫХ ФАКТОРОВ НА ПЛОД
К факторам, способным оказывать вредное влияние на плод, относятся следующие:
• гипоксия;
• перегревание;
• переохлаждение;
• ионизирующие излучения;
• органические и неорганические тератогены;
• инфекционные факторы;
• лекарственные вещества.
Обращаясь к истории, следует вспомнить о некоторых результатах исследований вредного влияния факторов внешней среды на эмбрион и плод. Например, Greg еще в 1941 г. показал, что заболевание матери краснухой - тератогенный фактор для плода. В конце 1950-х годов в Японии возникла болезнь Минамата (отравление ртутью). За последние 30-40 лет мы узнали: применение во время беременности диэтилстильбэстрола (синтетический эстроген, применялся в I триместре беременности для лечения угрозы прерывания) может быть причиной развития плоскоклеточного рака шейки матки и влагалища в 17-18 лет у девочек.
Проведенные за минувшие десятилетия эпидемиологические исследования выявили ряд лекарственных препаратов, обладающих очевидным тератогенным свойством.
Самым известным примером эпидемической вспышки пороков развития, обусловленной действием тератогенного лекарственного препарата, является случай с использованием талидомида (1961-1962).
Введение антифолиевого вещества аминоптерина (раньше специально использовался в качестве средства, вызывающего аборт) приводит к появлению у плода характерного синдрома пороков развития, прерыванию беременности.
Пороки развития возникали после назначения андрогенов, эстрогенов и прогестинов, оказывающих сильное воздействие на половую дифференцировку.
Сообщалось о довольно большом числе новорожденных, страдающих гипоплазией носового хряща и зернистостью костей, вызванными применением непрямого антикоагулянта варфарина. Наблюдались случаи пороков развития после использования препаратов, предназначенных для лечения заболеваний щитовидной железы. Кроме того, данные препараты порой становились причиной зоба с гипоили гипертиреозом у ребенка.
Противозачаточные гормональные средства способны обусловливать тератогенез с образованием пороков сердца и конечностей. Однако это относится к старым гормональным контрацептивам, тогда как в современных препаратах доза гормонов меньше, и прерывать беременность после их случайного приема нет необходимости.
Были сообщения о случаях развития глухоты у детей, подвергшихся внутриутробному воздействию стрептомицина или хинина. Глюкокортикоиды нередко способствуют расщеплению верхнего неба и губы (1:1000).
Тетрациклины, введенные матери приблизительно в 8-9 нед беременности, откладываются в костях плода и угнетают рост костей у плода и новорожденного, могут также вызывать изменение цвета зубов и развитие врожденной катаракты.
Назначение салицилатов связывали с самопроизвольным абортом, недоношенностью и геморрагической пневмонией у плода, а при использовании на поздних сроках - с закрытием боталлова протока.
В последние 20 лет стало очевидно: повреждающее действие лекарственных препаратов на плод часто выражается не в возникновении анатомических дефектов. Так, применение андрогенов, эстрогенов и прогестинов иной раз приводило к субанатомическим нарушениям сексуального поведения у мужчин и женщин.
Следует отметить: до сих пор неизвестны причины 80% всех пороков развития;только 10-15% их объясняются влиянием генетических и хромосомных факторов. По приблизительной оценке, только 1-5% врожденных дефектов возникают из-за лекарственных препаратов, остальные - из-за чего-либо другого.
Действие того или иного фактора определяется тем, на какой стадии внутриутробного развития он оказывает свое влияние, и в меньшей степени - характером самого фактора.
Период внутриутробного развития человека можно разделить на стадии, отраженные на рис. 118.
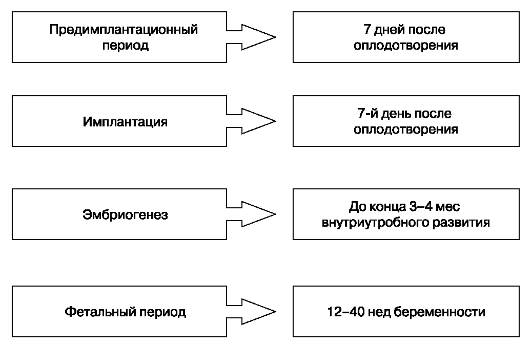 Рис. 118.Стадии внутриутробного развития
Рис. 118.Стадии внутриутробного развития
Стадия предимплантационного развития начинается с момента оплодотворения яйцеклетки и продолжается до внедрения бластоцисты в децидуальную оболочку на 7-8-й день после оплодотворения. Данный период характеризуется отсутствием морфологической связи между эмбрионом и органами репродуктивной системы женщины, однако это не исключает тесной функциональной связи. Существует представление об относительной устойчивости зародыша на стадии предимплантационного развития к действию повреждающих факторов внешней среды. В связи с выраженной способностью морулы и бластоцисты к полипотентности и регенерации различные патогенные факторы (гипоксия, ионизирующая радиация, химические агенты и др.) или не вызывают гибели зародыша и не нарушают последующее развитие плода, или приводят к его гибели (эмбриотоксический эффект). Такая закономерность известна под названием «все или ничего». Однако иногда повреждения, нанесенные зародышу в предимплантационный период, проявляются позже, во время имплантации и последующих стадий внутриутробного развития.
После имплантации начинаются органогенез и плацентация, которые в основном завершаются к 3-4 мес внутриутробной жизни. В этом периоде наиболее чувствительная фаза развития - первые 3-6 нед онтогенеза. В результате патогенного действия факторов внешней среды у эмбриона и плода в первую очередь поражаются те органы и системы, которые закладываются в данный момент.
После завершения процессов органогенеза и плацентации начинается плодный, или фетальный, период развития, который у человека продолжается до 40 нед беременности. На данной стадии эмбриотоксического и тератогенного действия практически не наблюдается, возможны лишь аномалии развития половых органов у плодов женского пола, возникающие под влиянием лекарственных препаратов андрогенного действия (ложный мужской гермафродитизм). Это связано с относительно поздним завершением формирования наружных половых органов плода человека (12-14 нед внутриутробного развития).
Многочисленные повреждающие факторы внешней среды могут проявить свой патогенный эффект путем проникновения через плаценту или в результате изменения ее нормальной проницаемости. Плацента человека относится к гемохориальному типу, что обеспечивает создание самого тесного контакта между кровью матери и плода. Под понятием «плацентарный барьер» имеют в виду расстояние между внутренней поверхностью капилляра плода и наружной поверхностью цитоплазматической мембраны синцития ворсин. Морфологическим субстратом плацентарного барьера является эпителиальный покров ворсин и эндотелий плодовых капилляров. Плацентарный барьер не пропускает в кровоток плода многие вещества. Контакт осуществляется на большой площади обменной поверхности плаценты - 12-14 м2.
Обладая ограниченной проницаемостью, плацента способна защищать организм плода от неблагоприятного действия многих токсических продуктов, попавших в организм матери.
Факторы окружающей среды, оказывающие повреждающее действие на эмбрион, называются эмбриотоксическими.
Тератогенез
Название «тератология» происходит от греческого слова «teras» (в переводе - «чудовище»). Термин «тератогенез» буквально означает производство уродов и уродливых организмов. В последние годы этот термин стал включать в себя понятие о функциональных аномалиях у новорожденного (в том числе о внутриутробной задержке развития и последующих поведенческих нарушениях). О тератогенезе почти ничего не было известно до 1950 г., а происхождение большинства врожденных дефектов считалось генетическим.
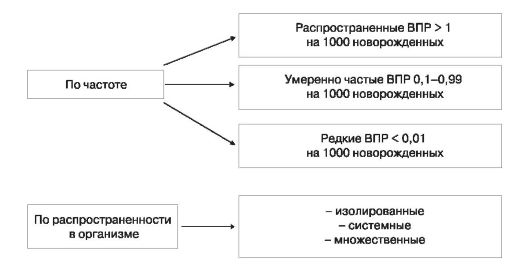
Классификации ВПР
 Типы ВПР
Типы ВПР
Мальформация - морфологический дефект в результате внутреннего нарушения процесса развития вследствие генетических факторов.
Дизрупция - морфологический дефект в результате внешнего препятствия или какого-либо воздействия на изначально нормальный процесс развития вследствие тератогенных факторов.
Деформация - нарушение формы, вида или положения части тела, обусловленное механическими воздействиями.
Дисплазия - нарушение организации клеток в ткани вследствие дисгистогенеза.
По тяжести проявления и прогнозу для жизнеспособности:
• летальные пороки развития (0,6%), приводящие к смерти ребенка (до 80% детей умирают в возрасте до 1 года жизни);
• ВПР средней степени тяжести, требующие оперативного вмешательства (2-2,5%);
• малые аномалии развития (до 3,5%), не требующие оперативного лечения и не ограничивающие жизненных функций ребенка.
В зависимости от срока действия вредных факторов:
• гаметопатии (мутации в половых клетках родителей и ненаследственные изменения в яйцеклетках и сперматозоидах), реализующиеся в виде наследственных заболеваний и синдромов;
• бластопатии (при поражении бластоцисты - зародыша первых 15 дней после оплодотворения), реализующиеся в виде двойниковых пороков, циклопии и др.;
• эмбриопатии (возникающие в период от 16-го дня до конца 8-й недели беременности и обусловленные тератогенными воздействиями различных физических, химических, биологических факторов), представляющие собой почти все изолированные и множественные ВПР;
• фетопатии (обусловленные повреждением плода в период от 9-й недели до окончания беременности), представленные редкими пороками дистопий и гипоплазий органов.
По анатомо-физиологическому принципу деления тела человека на системы органов.
1. Пороки ЦНС и органов чувств.
2. Пороки лица и шеи.
3. Пороки сердечно-сосудистой системы.
4. Пороки дыхательной системы.
5. Пороки органов пищеварения.
6. Пороки костно-мышечной системы.
7. Пороки мочевыделительной системы.
8. Пороки половых органов.
9. Пороки эндокринных желез.
10. Пороки кожи и ее придатков.
11. Пороки последа.
12. Прочие пороки.
Патогенез ВПР в настоящее время достаточно хорошо изучен. Нарушение развития зародыша на доимплантационной стадии при обратимых повреждениях клеток характеризуется их восстановлением, при необратимых приводит к гибели плода. На более поздних стадиях развития заместительные механизмы репарации поврежденных клеток не действуют, любое нарушение может привести к формированию пороков. Эмбриональный период характеризуется возникновением тканей из клеток эмбрионального зачатка и развитием органов и систем организма, взаимодействием генома зародыша и организма матери, ее гормональной и иммунной систем, связан с процессами размножения, миграции, дифференцировки клеток и формообразованием органов и тканей. Механизмы генетического контроля на поздних стадиях эмбриогенеза могут быть нарушены под воздействием различных внешних факторов, определяемых как тератогены.
Основные клеточные механизмы тератогенеза - изменения размножения (гипоплазия, аплазия органа), миграции (гетеротопии) и диффе-
ренцировки клеток (агенезии органов или систем). К основным механизмам тератогенеза на тканевом уровне относится гибель клеточных масс, замедление распада и рассасывания клеток, нарушение процессов склеивания клеток, что соответственно приводит к таким порокам, как атрезии естественных отверстий, свищи и дефекты в тканях.
Важную роль в определении причин развития ВПР сыграли патогенетические учения о критических и о тератогенных терминационных периодах.
Критические периоды в эмбриогенезе совпадают с периодами наиболее интенсивного формирования органов и характеризуются повышенной чувствительностью зародыша к повреждающему действию факторов внешней среды. Первый критический период у человека приходится на конец 1-й - начало 2-й недели беременности, когда повреждающий фактор чаще приводит к гибели зародыша. Второй критический период начинается с 3-й недели беременности, когда аналогичный фактор индуцирует порок развития.
Предельный срок формирования тех или иных органов, в течение которого повреждающий фактор может вызвать развитие порока в эмбриональном периоде, называют тератогенным терминационным периодом.
Каждый врожденный порок имеет свой терминационный период, поскольку сроки окончания формирования каждого конкретного органа, в течение которых тератогенный фактор может приводить к развитию порока, различны.
Этапы внутриутробного развития приведены в табл. 39.
Таблица 39
Дата добавления: 2016-03-04; просмотров: 1630;
