Графічне зображення хімічного потенціалу та зв’язок між інтегральними і парціальними властивостями.
На рис. 4.1 ми навели концентраційну залежність мольної енергії Гіббса, яка є інтегральною функцією. Ми вже знаємо, що парціальна мольна величина є частинною похідною екстенсивної функції по складу. Графічно це виглядає як дотична до концентраційної залежності самої функції в заданій точці складу. Такий графік показано нами рис. 4.2 для вільної енергії Гіббса двокомпонентного
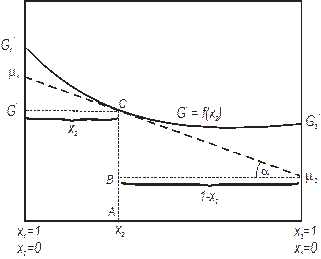
| Рис. 4.2. Графічне зображення парціальних мольних величин для випадку хімічних потенціалів. |
розплаву при заданих температурі і тиску. Вільна енергія Гіббса визначається як функція складу, парціальні мольні енергії Гіббса або хімічні потенціали компонентів 1 і 2 у розчині, m1 і m2, можуть бути отримані з мольної вільної енергії шляхом побудови дотичній до кривої у складі, що розглядається. На рис. 4.2 при складі х2 мольна вільна енергія дорівнює G. Точки G1 і G2 відповідають вільним енергіям чистих розплавлених компонентів при заданих температурі і тиску. Дотична до кривої в точці, що відповідає складу x2, перетинає ординати x1 = 1 і x2 = 1 при значеннях хімічних потенціалів компонентів 1 і 2, відповідно.
Покажемо, що відрізок АВ дорівнює хімічному потенціалу компонента 2, m2. Дійсно, АВ = АС – ВС,
АС = G при х2,
tga = -BC / 1-x2 = 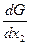
BC = -(1-x2) tga = -(1-x2) 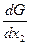
АВ = m2.= G + (1-x2) 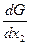 (4.25)
(4.25)
Подібним чином можна показати, що
m1 = G - x2 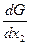 . (4.26)
. (4.26)
Отже, ордината дотичної при x2 = 0 є m1, при x2 = 1 вона дорівнює m2.
Це можна показати і аналітично.
Перепишемо рівняння (4.24) у вигляді
x1(∂m1/∂х2) + x2(∂m2/∂х2)= 0 (4.27)
Запишемо рівняння (4.25) у вигляді
G = m1(1-x2) + m2x2 (4.28)
і візьмемо диференціал по х2:
(∂G/∂х2) = m2 - m1 (4.29)
Рішаємо систему рівнянь (4.28) і (4.29):
m2 = m1 + (∂G/∂х2)
G = m1(1-x2) + [m1 + (∂G/∂х2)]x2 = m1(1-x2) + m1x2 + (∂G/∂х2)x2 = m1 + (∂G/∂х2)x2
m1 = G - x2(∂G/∂х2) (4.30)
m2 = G - x2(∂G/∂х2) + (∂G/∂х2) = G + (∂G/∂х2)(1 - x2), або
m2 = G + х1(∂G/∂х2) (4.31)
Слід зазначити, що хімічний потенціал компонентів 1 і 2 у розчині змінюється зі складом розчину, так як різні дотичні перетинають ординати в різних положеннях. Парціальні молярні величини пов'язані між собою для розчину з фіксованим складом. До того ж, пов’язані між собою і парціальні і інтегральні мольні величини, як ми щойно бачили.
Отже, хімічний потенціал, виражений через енергію Гіббса, є парціальною мольною величиною. А чи є парціальними мольними величинами хімічні потенціали, виражені через вільну енергію Гельмгольца, ентальпію, внутрішню енергію? Відповідь – ні. В чому різниця між хімічним потенціалом і парціальними мольними величинами? Парціальні мольні величини визначаються при постійних температурі і тиску, хімічні потенціали – при постійних об’ємі і ентропії для внутрішньої енергії, постійних тиску і ентропії для ентальпії, постійних об’ємі і температурі для вільної енергії.
Найбільш широко застосовною парціальною мольною величиною, окрім хімічного потенціалу, є парціальна мольна ентальпія. Якщо хімічний потенціал більш застосовний для гетерогенних систем, то парціальна мольна ентальпія – для гомогенних.
Для парціальних мольних величин застосовні ті ж співвідношення, що і до термодинамічних функцій чистих речовин. Так, вільну енергію для вільної кількості розчину можна записати як
G = H – TS, (4.32)
а вільну енергію компоненту 1 у розчині, або парціальну вільну енергію компоненту 1 у розчині, або хімічний потенціал компоненту 1 як:
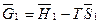 = m1 (4.33)
= m1 (4.33)
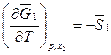 , (4.34)
, (4.34)
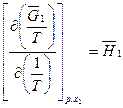 . (4.35)
. (4.35)
Дата добавления: 2016-02-27; просмотров: 778;
