Хімічний потенціал.
Для опису гомогенних і гетерогенних систем використовується єдина з парціальних мольних величин, а саме парціальна мольна вільна енергія Гіббса, яку Гіббс назвав хімічний потенціал і позначив літерою m. Отже, хімічний потенціал компоненту 1 – це частинна похідна вільної енергії по вмісту компонента 1 при постійних температурі, тиску і вмісті компоненту 2, або m1 = 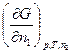 . Як парціальна величина він відповідає приросту вільної енергії G, якщо до нескінченної кількості розчину при сталих p, T і кількості другого компоненту додати 1 моль компонента 1. На відміну від парціальних мольних величин, для всіх термодинамічних потенціалів можна взяти подібні частинні похідні, звісно, при відповідних умовах. Всі вони є хімічними потенціалами:
. Як парціальна величина він відповідає приросту вільної енергії G, якщо до нескінченної кількості розчину при сталих p, T і кількості другого компоненту додати 1 моль компонента 1. На відміну від парціальних мольних величин, для всіх термодинамічних потенціалів можна взяти подібні частинні похідні, звісно, при відповідних умовах. Всі вони є хімічними потенціалами:
mі = 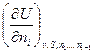 =
= 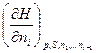 =
= 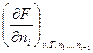 =
= 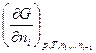 . (4.16)
. (4.16)
Запишемо в загальному випадку термодинамічний потенціал багатокомпонентного розчину, який містить n1 молей компонента 1, n2 молей компонента 2, … ni молей компонента і:
dG = -SdT + vdp + 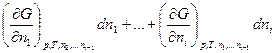 =
=
= -SdT + vdp + å 
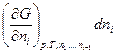 (4.17)
(4.17)
Рівняння термодинамічних потенціалів для фаз змінного складу можна записати як
dU = TdS – pdv + Smi dni (4.18)
dH = TdS + vdp + Smi dni (4.19)
dF = -SdT – pdv + Smi dni (4.20)
dG = -SdT + vdp + Smi dni (4.21)
На практиці для хімічного потенціалу як правило використовується похідна вільної енергії Гіббса, адже умови сталості тиску і температури найчастіше використовуються. Дуже змістовним є сам термін «хімічний потенціал», адже він є рушійною силою переносу маси.
Для хімічного потенціалу справедливі три основні рівняння для парціальних мольних величин:
dG = m1dx1 + m2dx2, (4.22)
G = m1x1 + m2x2 (4.23)
x1dm1 + x2dm2= 0 (4.24)
Останнє рівняння, як ми вже знаємо, називається рівнянням Гіббса-Дюгема. Воно дозволяє розрахувати хімічний потенціал компоненту 1, якщо відома концентраційна залежність хімічного потенціалу компонента 2.
Дата добавления: 2016-02-27; просмотров: 744;
