Потенціометричний метод аналізу рідин
-------------------------------------------------------------------------
Базується на вимірюванні різниці електричного потенціалу двох електродів, які поміщенні в досліджуваний розчин причому 1 електрод – допоміжний – має постійний потенціал, а потенціал другого – визначається активністю іонів. Електроди бувають 1-го і 2-го роду.
В електродах 1-го роду реакція йде між металом і його катіоном, який знаходиться в розчині (Hg, Ag, Cu, Pb, водневий електрод).
Водневий електрод являє собою губчату платину через яку продувається H2 малорозчинної солі і розчину добре розчиненої солі з аніоном, який є в малорозчиненій солі.
Приклад: хлор-срібний (Ag/AgCl/KCl), коломелевий електрод (Hg/HgCl2/KCl).
Електроди 1-го роду застосовуються рідко тому що окисні процеси на поверхні металу спотворюють потенціал електроду. В ряді випадків застосовують електрод з безперервним механічним очищенням. Є ще окремі групи електродів: це інертні матеріали, які застосовують для електричного контакту з рідиною.
Приклад: графіт
Найчастіше поширене вимірювання активності іонів водню:
[H2O] ↔ [H+] + [OH-]
Константа дисоціації: 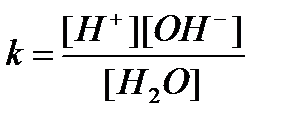
Застосовують спрощений вираз: 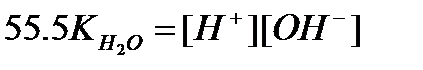
де 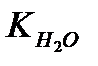 - іонний множник для води:
- іонний множник для води:
55,5· 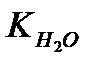 =10-14 при 22ºС
=10-14 при 22ºС
Датський фізик ввів поняття pH:
pH=-lg [H+]
pH – це десятковий логарифм, взятий зі знаком «-» від значення концентрації іонів водню
при 22ºС pH=-lg10-7=7
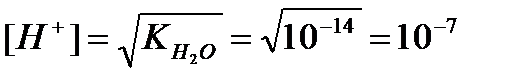
Активність іонів не завжди співпадає з концентрацією. Тому pH – це десятковий логарифм взятий зі знаком «-» від активності іонів.
При 0ºС pH=7.97
При 100ºС pH=6.12
pH=(0-14)
кислі середовища – pH<7
лужні середовища – pH>7
Використовують для вимірювання pH:
1. Порівняльний або допоміжний електрод (хлор-срібний або каломелевий), його потенціал постійний і не залежить від активності іонів.
2. Вимірювальний електрод – його потенціал залежить від активності іонів
Ідеальний по характеристиках, але не зручний у використанні електрод, його потенціал міняється на 58 мВ/1pH.
Тому замість водневого електроду у вимірюванні застосовують скляні електроди. Які мають таку саму характеристику, але в менших межах використання (1:13, 2:12 pH)
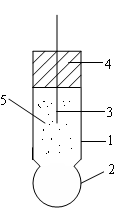
1. Скляна трубка;
2. Скляна сфера з легованого скла товщина стінки – 0,1мм і тонших;
3. Срібна дротина, покрита AgCl;
4. Ущільнювач;
5. Розчин HCl (KCl).
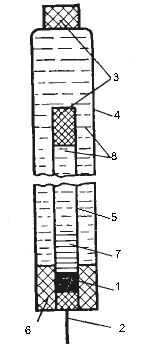
1. Ртуть;
2. Вивід;
3. Напівпровідникові перегородки;
4. Скляний опір;
5. Скляна трубка;
6. Ущільнювач;
7. Запущений розчин HgCl2;
8. Розчин KCl.
Система має вигляд
Ag | AgCl, HCl | скло | контрольований розчин | KCl, HgCl2| Hg
Скляний електрод має дуже великий верхній опір до 1000 МОм. У зв’язку з цим вимірювальні схеми pH-метрів мають мати дуже великий вхідний опір 1012Ом і споживати малий струм 10-12А. Тому застосовують спеціальні схеми підсилювачів.
Дата добавления: 2016-02-27; просмотров: 1284;
