Кондуктометричний метод аналізу рідин
-------------------------------------------------------------------------
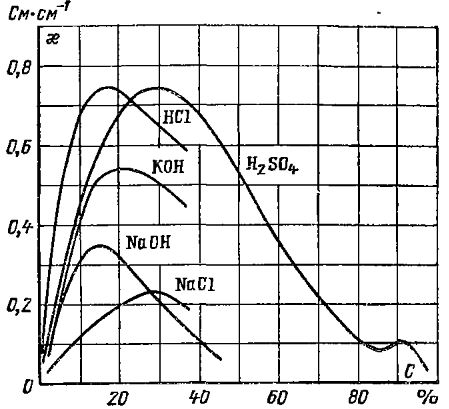
Базується на вимірюванні електричної провідності розчинів електролітів. Застосовується в лабораторії для побудови автоматичних кондуктометрів. При розчиненні електроліти дисоціюють з утвореними іонів. Характеристика – ступінь дисоціації. Електроліти сильні, слабі і неелектроліти. Властивість проводити струм характеризується питомою електричною провідністю æ:
æ0=1/V0 [см-1] – постійна електролітичної комірки.
Залежить від концентрації комірки. æ0=f(C)
В суміші компонентів визначають провідність розчину по адитивній залежності:
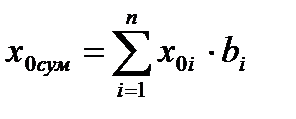
Де bi – об’ємна для компоненту
Метод придатний для бінарних і псевдобінарних розчинів. Електрична провідність сильно залежить від температури. При зміні температури на 1ºС міняється провідність на 1-2%
æ=Ae-β/T
де А і β – постійні коефіцієнти для розчину
Тому потрібна або термокомпенсація або термостабілізація. У вузьких межах використовуються лінійна залежність:
æt=æt0[1+α(t-t0)]
Кондуктометри діляться на контактні і безконтактні. Найпростіші – це контактні комірки з двома електродами. На результат впливають процеси, які протікають на між фазній поверхні електроду розчину електроліту. Електроди служать для підведення І і зняття падіння U.
Процеси, які спотворюють результат вимірювання:
1. Скачок потенціалу на границі метал-розчин
2. Процес зміни потенціалу при проходженні струму аналогічний заряду конденсатора.
Чотирьохелектричні комірки: два електроди для підведення I і два для зняття U. Мають вищу точність вимірювання. Струм має бути стабільний, не викликати теплового ефекту, коло повинно мати великий вхідний опір.
Дата добавления: 2016-02-27; просмотров: 1093;
