Задачи для самостоятельного решения. Задача 9.1.1. В цилиндре с подвижным поршнем находится 1 часть кислорода и 1 часть метана в состоянии термодинамического равновесия
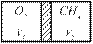
|
Задача 9.1.1. В цилиндре с подвижным поршнем находится 1 часть кислорода и 1 часть метана в состоянии термодинамического равновесия. Определить соотношение объемов.
Ответ: 0,5
Задача 9.1.2.Компрессор подает кислород в резервуар емкостью 3 м3. Избыточное давление его увеличивается от 0,1 до 6 ат, а температура от -15 оС до +30 оС. Определить количество закачанного кислорода, если барометрическое давление 745 мм рт. ст.
Ответ: 21,7 кг
Задача 9.1.3.Сжатый воздух в баллоне имеет температуру t = 15 oС, давление 4,8 МПа. Во время пожара температура воздуха поднялась до 450оС. 1. Взорвется ли баллон, если известно, что при этой температуре он может выдержать давление не более 9,8 МПа. 2. При t = 800 oС и давлении 1 ат плотность газа 0,45 кг/м3. Определить что это за газ.
Ответ: аргон
Задача 9.1.4.Баллон с кислородом емкостью 20 л находится под давлением 10 МПа при t = 15 oС. После израсходования части кислорода давление понизилось до 7,6 МПа, а температура упала до 10oС. Определить массу израсходованного кислорода.
Ответ: 0,606 кг.
Задача 9.1.5.В баллоне с метаном первоначальное давление составляло 320 кПа. При той же температуре повысили давление в баллоне
до 5000 кПа. Во сколько раз изменится плотность метана?
Ответ: в 15,6 раза.
Задача 9.1.6.В газгольдер при температуре 270С закачано 100000 м3 коксового газа. Какой объем будет занимать указанное количество газа при температуре 270 0С.
Ответ: 181000 м3.
Задача 9.1.7. Под давлением 100 кПа и при температуре 1230С находится 4,2 кг метана. Какой объем занимает метан?
Ответ: 0,86 м3.
Задача 9.1.8.Какова масса 10 м3 водорода, 10 м3 азота и 10 м3 метана при 10 ат и 1000С?
Ответ: H2=6,37 кг; N2 = 88,5 кг; CH4 = 50,6 кг.
Задача 9.1.9. Имеются газы: метан - 0,8 м3 при 10 ат (0,98 МПа), этан - 0,6 м3 при ат (0,59 МПа) и пропан - 0,4 м3 при 4 ат (0,39 МПа)
Найти давление их смеси в объеме 1 м3 и молярные концентрации.
Задача 9.1.10.Определить, сколько углекислоты (СО2) может раствориться в 15 т воды при нормальном давлении и температуре 20 0С.
Нормальные и стандартные условия
Пример 9.1.9.Определить объем газа при нормальных условиях, если его объем при температуре 125 0С и давление 15 ат составляет 100 м3.
Решение
Согласно уравнению объем газа при нормальных условиях будет
 нм3
нм3
Задача 9.1.11. Объем газа, собранного над водой при 20 0С и барометрическом давлении 750 мм рт. ст., равен 1,2 м3. Какой объем займет указанное количество газа при нормальных условиях?
Ответ: V0=1,08 нм3.
Дата добавления: 2016-02-27; просмотров: 3299;
