Глава 4. ТЕХНОЛОГИЯ РЕКОМБИНАНТНЫХ ДНК, ИЛИ ГЕННАЯ ИНЖЕНЕРИЯ
Технология рекомбинантных ДНК (также молекулярное клонирование, или генная инженерия) - это совокупность экспериментальных процедур, позволяющих осуществлять перенос генетического материала (ДНК) из одного организма в другой. В настоящее время можно вырезать отдельные участки ДНК, получать нуклеотиды на ДНК-синтезаторах (приборах для автоматического химического синтеза ДНК) практически в неограниченном количестве, определять последовательность нуклеотидов (разделяя, секвенируя их) сотнями в сутки, изменять выделенный ген, вводить его вновь в геном культивируемых клеток или эмбриона животного, где этот измененный ген начинает функционировать. Эксперименты с рекомбинантными ДНК используют крупномасштабно в промышленном производстве БАВ. Эксперименты по клонированию включают следующие этапы:
1. Рестриктазное расщепление из организма-донора нужных генов нативной ДНК (клонируемая ДНК, встраиваемая ДНК, ДНК-мишень, чужеродная ДНК).
2.Быстрая расшифровка всех нуклеотидов в очищенном фрагменте ДНК, позволяющая определить точные границы гена и аминокислотную последовательность, кодируемую геном.
3. Обработка рестрикционными эндонуклеазами вектора для клонирования, который может реплицироваться в клетке-хозяине.
4. Сшивание ДНК-лигазой двух фрагментов ДНК с образованием новой рекомбинантной молекулы - конструкция «клонирующий вектор - встроенная ДНК».
5. Введение этой конструкции в клетку хозяина (реципиента), где она реплицируется и передается потомкам. Этот процесс называется трансформацией. После трансформации бактериальная клетка воспроизводит фрагмент клонируемой ДНК миллионами идентичных клеток.
6. Идентификация и отбор клеток, несущих рекомбинантную ДНК (трансформированные клетки).
7. Получение специфичного белкового продукта, синтезированного клетками-хозяевами (рис. 6).
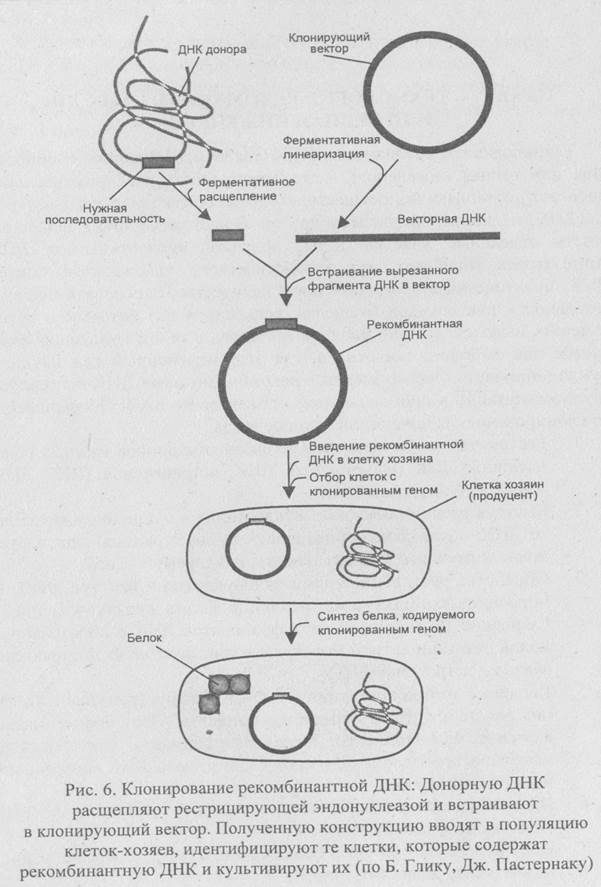
Конструирование рекомбинантных молекул осуществляется с помощью ряда ферментов — обязательного и незаменимого инструмента практически всех этапов этого сложного процесса, прежде всего ферментов рестрикции (рестрицирующих эндонуклеаз, рестриктаз). Рест-риктазы являются составной частью системы рестрикции — модификации прокариотических клеток. Эта система связана с защитой клеток от проникновения чужеродной ДНК. Система модификации осуществляет метилирование собственной ДНК в сайтах ее узнавания немедленно после репликации; чужеродную ДНК, проникающую в клетку, бактерии гидролизуют с помощью рестриктаз.
Различают три основных класса рестриктаз. Рестриктазы класса I разрывают молекулы ДНК в произвольных точках, рестриктазы I и III классов обладают метилирующей и эндонуклеазной активностью. Ферменты II класса, которые и используются в генной инженерии, состоят из двух отдельных белков: рестрикционной эндонуклеазы и модифицирующей метилазы.
В настоящее время используется свыше 400 различных рестриктаз. Эти ферменты синтезируют самые разнообразные микроорганизмы. Для их культивирования необходимы оптимальные условия (температура, состав и рН среды, концентрация кислорода и т.д.). С целью повышения продуктивности и стандартизации процесса получения этих ферментов клонируют гены рестрицирующих эндонуклеаз в Е. соli.
Рестриктазы узнают и расщепляют специфические нуклеотидные последовательности в двухцепочечной молекуле ДНК. При молекулярном клонировании важно, чтобы расщепление донорной и векторной ДНК происходило в строго определенных участках (сайтах). Каждый фермент рестрицирующих эндонуклеаз «опознает» в ДНК специфическую последовательность из 4-6 нуклеотидов. Многие рестрицирующие эндонуклеазы вносят разрывы в две цепи ДНК со смещением на несколько нуклеотидов, располагаясь наискось друг от друга. Б результате образуются одноцепочечные комплементарные концы с «хвостами» из 4-х нуклеотидов в каждом («липкие» концы). Кроме рестриктаз, расщепляющих нуклеотидную цепь с образованием липких концов, существуют рестриктазы, вносящие разрывы в цепи строго друг против друга с образованием ДНК с «тупыми концами».
Одних ферментов рестрикции при молекулярном клонировании недостаточно, так как водородные связи между теми четырьмя основаниями, которые образуют липкие концы, не столь прочны, чтобы удержать два объединившихся фрагмента ДНК. Для устранения разрыва в сахарофосфатном остове молекулы служит фермент ДНК-лигаза, катализирующий образование фосфодиэфирных связей между концами по-линуклеотидных цепей, которые удерживаются вместе при спаривании липких концов. ДНК-лигаза сшивает и тупые концы.
Таким образом, одна часть рекомбинантной молекулы ДНК несет нужный ген, который предполагается клонировать, другая — содержит информацию, необходимую для репликации в клетке рекомбинантной ДНК. Кроме того, при ДНК-рестрикции образуются разнообразные фрагменты и после их лигирования (соединения фосфодиэфирной связью) с векторной ДНК появляется множество различных комбинаций фрагментов, например, объединяющих между собой фрагменты донорной ДНК и векторные ДНК. Для уменьшения количества последних рестрицированную векторную ДНК обрабатывают щелочной фосфатазой.
Для введения рекомбинантной ДНК применяют два основных вектора:
1) Плазмиды.
2) Бактериофаги.
Плазмиды представляют собой внехромосомный генетический элемент в виде кольцевых молекул ДНК, содержащих 1-3% генома бактериальной клетки. Плазмиды есть у всех бактерий. Одни из них содержат информацию, обеспечивающую их собственный перенос из одной клетки в другую (Р-плазмиды), другие - несут гены устойчивости к антибиотикам (R-плазмиды) или специфические наборы генов, ответственных за утилизацию метаболитов (плазмиды деградации). Каждая плазмида содержит сайт начала репликации, без которого репликация плазмиды в клетке-хозяине невозможна. Если две или более плазмиды не могут сосуществовать в одной и той же клетке — они принадлежат к одной группе несовместимости. Плазмиды, относящиеся к разным группам несовместимости, беспрепятственно существуют в одной клетке независимо от числа копий. У некоторых микроорганизмов в одной клетке обнаружено до 10 разных плазмид, каждая из которых выполняла свои функции и относилась к своей группе несовместимости. Репликация плазмид идет независимо от репликации хромосом. Количество копий определяется регуляторной системой клетки.
Таким образом, плазмиды обладают свойствами, позволяющими использовать их в качестве вектора для переноса клонируемой ДНК. Бактериальный клон, содержащий такую плазмиду, можно сравнить с фабрикой по производству этого фрагмента.
Плазмидные векторы, как правило, создают методом генной инженерии, так как природные (немодифицированные) плазмиды лишены ряда обязательных для «высококачественного вектора» свойств:
• небольшого размера, так как эффективность переноса экзогенной ДНК в Е. соli снижается при длине плазмиды более 15 тысяч пар нуклеотидов;
• наличия сайта рестрикции, в который осуществлена вставка;
• наличия одного или более селективных генетических маркеров для идентификации реципиентных клеток, несущих рекомби-нантную ДНК.
Вводят плазмиды в соматические клетки с помощью химических реагентов, повышающих проницаемость клеточной оболочки. В частности, чтобы обеспечить проникновение в клетки плазмидной ДНК, их обрабатывают ледяным раствором кальция хлорида, затем выдерживают при 42 °С в течение 1,5 мин. Эта обработка приводит к локальному разрушению клеточной стенки. Максимальная частота трансформации - 10 , т.е. на каждую тысячу клеток приходится одна трансформированная. Частота трансформации не бывает 100%-й, затем используют схемы отбора, позволяющие идентифицировать трансформированные клетки.
В качестве маркеров плазмида может содержать гены, определяющие устойчивость бактерии к антибиотикам. Вставка чужеродного (до-норного) гена в маркерный ген приводит к инактивации последнего. Это позволяет отличать трансформированные клетки, получившие векторную плазмиду (утратившие устойчивость к антибиотику), от клеток, получивших рекомбинантную молекулу (сохранивших устойчивость к одному, но утративших устойчивость к другому антибиотику). Этот прием называется инактивацией маркера вставки.
Для отбора трансформированных клеток, содержащих рекомбинантную ДНК (гибридную плазмиду), проводят тестирование на рези-стентность к определенным антибиотикам. Например, клетки, несущие гибридную плазмиду, устойчивы к ампициллину, но чувствительны к тетрациклину (в маркерный ген которого и внедрена донорная ДНК).
Процесс разделения геномной ДНК на клонируемые элементы и введения этих элементов в клетки-хозяева называется созданием геномной библиотеки (банка клонов, банка генов).
Все системы клонирования должны отвечать двум основным требованиям:
1)Наличию нескольких сайтов для клонирования;
2) Возможности достаточно простой идентификации клеток с ре-комбинантными ДНК.
Для всех рутинных процедур молекулярного клонирования широко используется Е. соli в качестве клетки-хозяина. Клетки, способные поглощать чужеродную ДНК, называются компетентными; компетентность Е.соli повышают, используя специальные условия культивирования. Для получения больших количеств чужеродных белков с помощью рекомбинантных штаммов Е. соli была сконструирована плазмида, содержащая сильный промотор, селективный маркерный ген и короткий участок с несколькими уникальными сайтами для рестрицирующих ферментов - полилинкер.
Эффективными методами трансформации Е. соН плазмидами является электропорация (воздействие на клеточные мембраны электрическим током для увеличения их проницаемости). Для введения клонированных генов в соматические клетки также применяют микроинъекции и микроукалывания или слияние с клеткой нагруженных ДНК мембранных везикул (липосом).
Использование бактериофагов в качестве носителей генетической информации основано на том, что рекомбинантный ген встраивается в геном вируса ив последующем реплицируется с генами вируса при размножении в инфицированной клетке-хозяина. С этой целью применяют бактериофаг ^.-вирус с двухцепочечной ДНК, которая после проникновения в клетку смыкается в кольцо. Бактериофаг М-13 - вирус нитевидной формы с кольцевой замкнутой ДНК, которая в клетке превращается в двухцепочечную и реплицируется в клетках-потомках. В поисках эукариотических систем экспрессии, для получения биологически активных белков, созданы бакмиды - экспрессирующие векторы на основе бакуловирусов для Е. соН и клеток насекомых. Выход рекомбинантных бакуловирусов в такой системе повысился до 99%. Клетки насекомого, инфицированные бакуловирусами, синтезировали гетероло-гичный белок. Векторы на основе фага удобны для создания клонеток (банка генов), но не для тонких манипуляций сфрагментом ДНК. Для детального изучения и преобразования фрагменты ДНК переклонируют в плазмиды.
Кроме указанных векторов в генной инженерии применяют косми-ды - плазмиды, несущие соs-участок (комплементарные липкие концы) ДНК фага X. Наличие соs-участка позволяет производить упаковку ДНК в головку фага in vitro, что обеспечивает возможность их введения в
клетку путем инфекции, а не трансформации. Фазмиды - гибриды между фагами и плазмидами - способны развиваться как фаг и как плаз-мида. Уступая космидам по клонирующей емкости, фазмиды дают возможность отказаться от переклонирования генов из фаговых в плазмид-ные векторы.
Таким образом, для получения любого белкового продукта необходимо обеспечить правильную транскрипцию кодирующего его гена и трансляцию соответствующей мРНК. Для инициации транскрипции (синтеза РНК) в нужном сайте необходим промотор, для ее остановки -терминирующий кодон.
Для синтеза разнообразных белков, кодируемых клонированными генами, интенсивно используют обычные дрожжи S. сегеvisiае; генетика этих одноклеточных организмов хорошо изучена. Рекомбинантные белки, синтезированные в системах экспрессии S. сегеvisiае, применяют в качестве вакцин и лекарственных препаратов
Придавать новые свойства существующим белкам, создавать уникальные ферменты возможно, производя специфические изменения с помощью плазмид или ПЦР. Клонированные гены позволяют получать белки, содержащие нужные аминокислоты в заданных сайтах. Внесение специфических изменений в кодирующие последовательности ДНК, приводящие к определенным изменениям в аминокислотных последовательностях, называется направленным мутагенезом.
Тест-контроль к главе 4 Выберите правильные ответы:
1. Утверждение, что генетическая рекомбинация заключается в обмене генами между двумя хромосомами:
А - верно;
Б - ошибочно;
В - требует уточнения.
2.Процесс изготовления генно-инженерных препаратов включает:
А - копирование гена человека, ответственного за синтез необходимого продукта;
Б - модификацию генетического аппарата больного для увеличения
биосинтеза необходимых продуктов;
В - внедрение микробной клетки с рекомбинантной ДНК в организм
человека;
Г - культивирование и выделение микробных клеток с рекомби-
нантными ДНК;
Д - внедрение микробной клетки с рекомбинантной ДНК в организм
животного;
Е - внедрение человеческого гена в плазмиду микробной клетки.
3.Функциональная активность рестрицирующих эндонуклеаз:
А - метилирование нуклеотидов;
Б — гидроксилирование нуклеотидов;
В - расщепление ДНК;
Г — сшивка нуклеотидов;
Д - репликация нуклеотидов.
4.Функциональная активность ДНК-лигаз:
А - лизирование (растворение, гидролиз) ДНК;
Б - образование фосфодиэфирных связей между концами полинук-
леотидных цепей;
В — метилирование нуклеотидов;
Г - нейтрализация ДНК;
Д - расщепление ДНК.
5. Защита клеток от проникновения чужеродной ДНК заключается в:
А - регулировании проницаемости клеточной мембраны;
Б — укрупнении чужеродной ДНК;
В - гидролизе (расщеплении) чужеродной ДНК;
Г — метилировании чужеродной ДНК;
Д — нейтрализации чужеродной ДНК.
6. Для введения рекомбинантной-ДНК в производстве препаратов методом генной инженерии используют:
А — хромосомы;
Б - плазмиды;
В - рибосомы;
Г - бактериофаги;
Д - лизосомы;
Е - ядра клеток.
7. Плазмида представляет собой:
А — определенный штамм кишечной палочки, используемый для
биотехнологических целей;
Б - кольцеобразную молекулу ДНК;
В - участок цепи РНК, несущий информацию о структуре гена;
Г - внехромосомный элемент генетической информации;
Д — вирус, размножающийся в цитоплазме микробной клетки;
Е — хромосому, используемую в качестве вектора для введения ДНК
в клетки бактерий.
8. Требования к векторам ДНК:
А - малый размер;
Б — большой размер;
В - видоспецифичность;
Г - наличие селективных генетических маркеров для идентификации реципиентных клеток, несущих рекомбинантную ДНК;
Д - наличие сайта рестрикции, в который осуществлена вставка.
9. Отбор трансформированных клеток, содержащих рекомбинантную ДНК (гибридную плазмиду) проводят:
А - тестированием на резистентность к различной температуре;
Б — тестированием на резистентность к определенным антибиотикам;
В - по способности окрашиваться гематоксилином; Г — по морфологическим признакам; Д — по скорости роста и размножения.
10. Способы введения клонированных генов в соматические клетки:
А - микроинъекции; '
Б - с помощью химических реагентов, изменяющих проницаемость
мембран;
В - с помощью липосом, «теней» эритроцитов;
Г - экстракорпоральной обработкой хромосом бактериальной
клетки;
Д - инфекцией клетки рекомбинантными вирусами.
Дата добавления: 2016-02-24; просмотров: 3211;
