Приготовление посевного материала
Штаммы микроорганизмов для производства биологических препаратов поступают в ампулах, где они законсервированы в виде чистых культур. Каждая культура имеет паспорт с описанием питательных сред, морфологических, физиологических и других характеристик, условий для их поддержания, выращивания и срока хранения. Режим хранения культур предполагает охлаждение, замораживание или обезвоживание; во всех случаях должен быть резко сокращён или полностью прекращён клеточный обмен веществ. Культуры штаммов хранят: на косом агаре при температуре минус 1-5 °С; замороженными при температуре ниже —20 °С (недопустимо повторное оттаивание и замораживание);
лиофилизированными в ампулах, хранящимися в течение нескольких лет.
Большинство культур клеток млекопитающих, в том числе и клеток человека, удается сохранить неопределенно долгое время замороженными в специальной среде при температуре - 180 °С.
Через определённое время, специфическое для каждого вида микроорганизмов и вида хранения, культуру пересеивают.
Перед началом технологического процесса культуру размножают в стерильных условиях при оптимальном составе питательной среды и режиме выращивания, длительность стадии выращивания — 24 ч.
Культивирование
Стадия культивирования микроорганизмов является наиболее сложной и ответственной.
Рост и культивирование биомассы требуют следующих условий:
•жизнеспособности посевного материала;
•наличия источника энергии (тепла);
• достаточного количества соответствующей питательной среды;
• необходимых физико-химических условий для жизнедеятельности.
С начала 1950-х гг. вирус полиомиелита для производства вакцины выращивали в культуре клеток млекопитающих, в том числе фибробла-стов эмбриона человека. С тех пор фибробласты эмбриона стали незаменимы для выделения и выращивания ряда других вирусов, при производстве высокоспецифичных белков (антител, интерферонов), в исследованиях рака и противовирусной химиотерапии.
Культуры, приготовленные непосредственно из тканей организма (эмбриональных или тканей новорожденных), называют первичными культурами. В большинстве случаев клетки первичной культуры переносят из культуральной чашки и используют для получения большого количества вторичных культур, которые можно последовательно перевивать в течение недель или месяцев. Разные типы клеток нуждаются в различных питательных веществах, а также в одном или нескольких белковых факторах роста.
Клеточные линии можно использовать для получения клонов, которые происходят из одной клетки-предшественника.
Биотехнология использует методы поверхностного и глубинного культивирования микроорганизмов.
При поверхностном культивировании (в монослое) суспензию клеток получают обработкой измельчённой ткани эмбриона трипсином. Клетки в такой суспензии, оседая на плотной поверхности сосуда с культуральной средой, становятся плоскими иделятся, образуя монослой на поверхности сосуда. Обычно при этом способе культивирования пользуются цилиндрическими бутылями, которые медленно вращаются вдоль своей длинной оси. Рост клеток и выход биомассы можно увеличить, добавив к суспензии носитель — микроскопические гранулы из инертного синтетического полимера, на которых клетки закрепляются и пролиферируют. Суспензионные культуры можно получать в сосудах объёмом до 1000 л при перемешивании.
Преобладающим является глубинный метод культивирования, предполагающий возможность использования всего объема питательной среды.
На рост и развитие микроорганизмов влияют внутри- и внеклеточные факторы. К внутриклеточным факторам относятся: структура клетки, механизмы метаболизма и генетические характеристики. Внеклеточные (внешние) факторы, т.е. условия внешней среды клетки, являются основными регуляторны.ми факторами биотехнологии.
Промышленное культивирование и очистка целевого продукта -процессы многоступенчатые. Общая схема ферментации представлена на рис. 8.
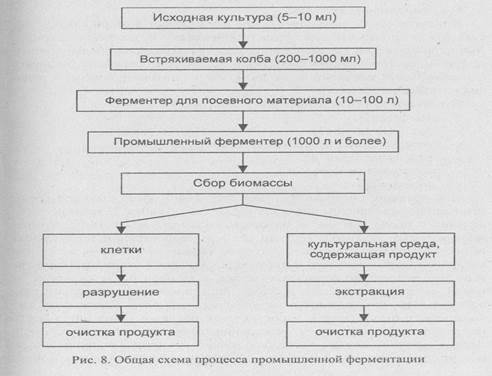
Процесс начинается с приготовления и стерилизации культуральной среды и оборудования. Вначале выращивают исходную культуру (5-10 мл), затем инкубируют ее во. встряхиваемой колбе (200-1000 мл), далее переносят в ферментер для посевного материала (10-100 л) и, наконец, в промышленный ферментер (1000-100000 л). По завершении ферментации выделяемый продукт находится в клетках или в культуральной среде, но не в обеих фракциях одновременно, поэтому дальнейшие манипуляции проводят с одной из этих фракций.
Микроорганизмы можно выращивать:
• в ферментере периодического действия;
• в ферментере периодического действия с добавлением субстрата;
• в непрерывной культуре.
В первом случае микроорганизмы выращивают в стерильных условиях без добавления в ходе ферментации свежей культуральной среды. При периодической ферментации состав культуральной среды, концентрация микроорганизмов (биомассы), количество белкового продукта или метаболита зависят от фазы роста, клеточного метаболизма и наличия питательных веществ.
Различают шесть основных фаз роста (рис. 9):
лаг-фаза (1);
фаза ускорения (2);
экспоненциальная или логарифмическая фаза (3);
фаза замедления (4);
стационарная фаза (5);
фаза отмирания (6).
Как правило, после инокуляции стерильной культуральной среды мгновенного увеличения числа клеток не наблюдается. В течение определенного периода времени, называемого лаг-фазой, клетки адаптируются к новым условиям (другим рН или концентрации питательных веществ). Продолжительность лаг-фазы зависит от времени, в течение которого клетки посевного материала находились в стационарной фазе, и от того, насколько различалась среда, в которой росла культура, от новой, свежей культуральной среды. Если посевным материалом служит культура, находящаяся в экспоненциальной фазе, выраженная лаг-фаза может отсутствовать и рост клеток начнется немедленно после инокуляции. Между лаг- и экспоненциальной фазами есть короткий период — фаза ускорения, когда скорость роста клеток увеличивается до достижения постоянной величины. В период экспоненциальной фазы клетки претерпевают несколько делений. Когда субстрат присутствует в избытке, достигается максимальная скорость роста культуры в экспоненциальной фазе, из-за большого числа клеток в конце экспоненциальной фазы субстрат расходуется очень быстро, наступает фаза замедления, которая может быть кратковременной. В результате истощения лимитирующего субстрата или накопления продуктов метаболизма, замедляющих рост, увеличение числа клеток постепенно прекращается
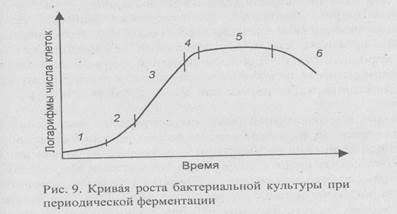
и культура переходит в стационарную фазу. В это время биомасса остается постоянной, метаболизм претерпевает кардинальные изменения, синтезируются соединения (вторичные метаболиты), представляющие коммерческий интерес, например антибиотики. Продолжительность стационарной фазы зависит от конкретного микроорганизма и условий роста. В фазе отмирания метаболизм прекращается, так как энергетические запасы клеток оказываются исчерпанными. При промышленном синтезе, еще до наступления фазы отмирания, ферментацию останавливают.
Периодическая культура с добавлением субстрата предполагает периодическое внесение в ферментер увеличивающегося количества питательных веществ. При этом культуральную среду не удаляют до окончания процесса. Периодическое добавление субстрата приводит к удлинению экспоненциальной и стационарной фаз, к увеличению биомассы и количества метаболитов, синтезируемых во время стационарной фазы. Для обеспечения непрерывного синтеза рекомбинантного белка и его стабильности необходим тщательный контроль процесса и добавление субстрата (источника углерода, азота, витаминов, микроэлементов и др. БАВ) тотчас, как в этом возникает необходимость.
В зависимости от генотипа микроорганизма и природы рекомби-нантного белка периодическая ферментация с добавлением субстрата может повысить выход готового продукта на 25-1000% по сравнению с простой периодической ферментацией.
Периодическая ферментация с добавлением субстрата используется также для культивирования клеток млекопитающих и насекомых; эти культуры широко применяют для получения белковых продуктов, имеющих медицинское значение, кроме того, без периодического добавления субстрата, клетки млекопитающих неэффективно синтезируют чужеродные белки. Для периодической ферментации характерны небольшие различия во времени сбора клеток, который проводят, начиная с середины экспоненциальной фазы, и заканчивают ее поздним этапом.
Однако в стационарной фазе микроорганизмы часто синтезируют протеолитические ферменты - протеиназы, разрушающие производимые белки; если цель ферментации - получение белковых продуктов, нужно остановить процесс до перехода его в стационарную фазу. Определяя время добавления следующей порции субстрата, используют показатели, коррелирующие с его расходом: количество синтезированных органических кислот, значение рН или количество образовавшегося СО2. Конечный продукт собирают по завершении процесса.
При непрерывной ферментации свежая культуральная среда поступает в ферментер непрерывно, параллельно отводится такой же объем клеточной суспензии. Таким образом, убыль числа клеток (удаление продукта) уравновешивается их увеличением в результате деления. При этом жестко контролируют скорость притока культуральной среды и постоянный объем культуры в биореакторе.
Следует заметить, что в промышленных целях непрерывная ферментация применяется реже, хотя стоимость получения определенного количества биомассы в ферментере непрерывного действия существенно ниже, чем в биореакторе, работающем в периодическом режиме. Это удешевление обусловлено следующим:
-при непрерывной ферментации нужны не столь громоздкие биореакторы и оборудование для сбора клеток, их разрушения, последующей очистки белкового продукта или метаболита, синтезированного микроорганизмами;
-биореактор периодического действия время от времени разгружают, готовя к повторному использованию (ремонт, чистка, стерилизация биореактора - основная причина снижения эффективности процесса); для ферментера, работающего в непрерывном режиме, простой существенно меньше;
- при непрерывной ферментации синтез целевого продукта происходит более согласованно, так как физиологический статус большинства клеток одинаков.
Непрерывную ферментацию используют для промышленного получения белков одноклеточных микроорганизмов и антибиотиков, однако и этот способ выращивания микроорганизмов связан с определенными затруднениями:
• продолжительность ферментации в непрерывном режиме со-ставляет иногда 500-1000 ч, в течение которого некоторые клетки могут потерять рекомбинантные плазмиды (известно, что клетки, не несущие плазмид, расходуют меньше энергии, делятся быстрее, поэтому со временем выход целевого продукта может снижаться из-за уменьшения числа клеток, способных его синтезировать);
• в промышленных установках затруднительно в течение длительного времени поддерживать стерильные условия; непре- • рывные процессы требуют наличия стерильного резервного оборудования, что значительно увеличивает основные затраты.
Культуры с высокой плотностью. При максимальной конечной плотности культуры получается и максимальное количество целевого продукта. В ферментерах периодического действия с добавлением субстрата концентрация рекомбинантных клеток Е.соli достигает 50 г сухого вещества на 1 л питательной среды (в некоторых случаях более 100 г/л). Один из способов повышения плотности культуры — оптимизация культуральной среды.
Следует иметь в виду, что некоторые питательные вещества (в том числе источники углерода, азота) при высоких концентрациях замедляют рост клеток. Так, глюкоза подавляет рост при концентрации более 50 г/л, аммиак - при концентрации свыше 3 г/л; железо, магний, фосфор, цинк соответственно - более 1,15 г/л, 8,7 г/л, 10 г/л, 0,038 г/л.
Таким образом, простое увеличение содержания питательных веществ в культуральной среде при периодической ферментации не дает желаемого результата.
Для избежания недостатка кислорода в культурах с высокой плотностью повышают количество поступающего диспергированного воздуха и скорость перемешивания. Возможна подача в культуру чистого кислорода, а не воздуха (содержащего только 20% кислорода) или выращивание клеток под определенным давлением для увеличения растворимости кислорода.
Высокой плотности роста культуры удается достичь в периодическом режиме с добавлением субстрата. Режим подачи питательных веществ может быть: непрерывным, ступенчатым, экспоненциальным. При непрерывном режиме в культуральную среду в течение всей ферментации вносят одинаковые количества питательных веществ. При ступенчатом режиме питательные вещества добавляют во все большем количестве по мере увеличения концентрации клеток. При экспоненциальном режиме питательные вещества добавляют в количестве, обеспечивающем постоянную скорость роста клеток.
Периодическую подачу питательных веществ автоматизируют, основываясь на результатах измерения концентрации лимитирующего субстрата культуральной среды (например глюкозы) в процессе ферментации.
При крупномасштабной ферментации следует учитывать еще один аспект. Важно не допустить случайного попадания рекомбинантных микроорганизмов в окружающую среду; для этого используют надежные системы, предотвращающие утечку живых рекомбинантных организмов или ограничивающие их распространение при произошедшей утечке.
Перед окончательным удалением из установки, все рекомбинантные микроорганизмы должны быть инактивированы в соответствии с определенными инструкциями. Использованную культуральную среду тщательно проверяют на наличие в ней жизнеспособных микроорганизмов, чтобы исключить их попадания в окружающую среду.
5.4. Аппаратурное оформление биотехнологического процесса.
Биореакторы
Промышленное производство биопрепаратов представляет собой сложный комплекс взаимосвязанных физических, химических, биофизических, биохимических, физико-химических процессов и предполагает использование большого количества разнотипного оборудования, которое связано между собой материальными, энергетическими потоками, образующими технологические линии.
Основным аппаратурным элементом биотехнологического процесса является биореактор - ферментер(рис. 10). Биореакторы предназначены для культивирования микроорганизмов, накопления биомассы, син-

теза целевого продукта. Биореакторы изготавливают из высоколигиро-ванных марок стали, иногда из титана. Внутренняя поверхность биореактора должна быть отполирована.
Типовые ферментеры представляют собой вертикальные ёмкости различной вместимости (малые - от 1 до 10 л, многотоннажные - более 1000 л) с минимальным числом штуцеров и передающих устройств. В биореакторах должны быть обеспечены оптимальные гидродинамические и массообменные условия.
Ферментеры снабжены паровой рубашкой, мешалками, барботера-ми, стерилизующими воздушными фильтрами, отбойниками, обеспечивающими необходимые температурный, газовый режим, гидродинамическую обстановку в биореакторе (т.е. процессы массо- и теплообмена). В биореакторах имеются пробоотборцики для отбора проб культураль-ной жидкости в процессе биосинтеза. Могут быть и другие конструктивные особенности, учитывающие специфику биотехнологического процесса. Работа отдельных узлов контролируется измерительными приборами, фиксирующими как параметры технологического процесса, так и отдельные физико-химические показатели культивирования (температуру стерилизации и культивирования, скорость вращения мешалки, давление, расход воздуха или газов на аэрацию, пенообразование, рН, еН, рО2, рСО2 среды).
Тип биореактора, чистота обработки внутренних стенок аппарата и отдельных его узлов, ёмкость, коэффициент заполнения, поверхность теплоотдачи, способ отвода тепла, тип перемешивающих, аэрирующих устройств, арматура и запорные приспособления, способ пеногашения, — далеко не полный перечень отдельных элементов, которые, в отдельности и во взаимосвязи, влияют на процесс культивирования микроорганизмов и клеток.
Биореакторы подразделяют на три основные группы (рис. 11):
1) реакторы с механическим перемешиванием;
2) барботажные колонны, через которые для перемешивания содержимого пропускают воздух;
3) эрлифтныереакторы с внутренней или внешней циркуляцией; перемешивание и циркуляция культуральной среды в них обеспечивается потоком воздуха, за счет которого между верхним и нижним слоями культуральной среды возникает градиент плотности.
Биореакторы первого типа используют чаще всего, так как они позволяют легко изменять технологические условия и эффективно доставлять к растущим клеткам воздух, определяющий характер развития микроорганизмов и их биосинтетическую активность. В таких реакторах воздух подают в культуральную среду под давлением через разбрызгиватель - кольцо с множеством маленьких отверстий. При этом
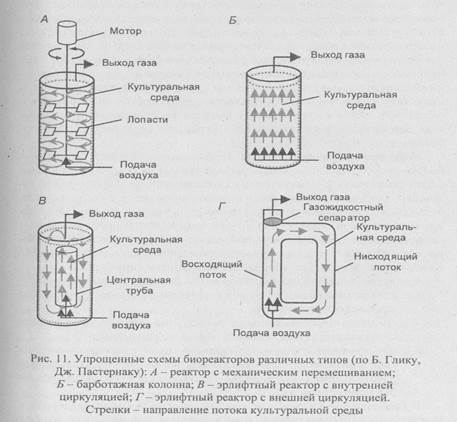
Биореакторы первого типа используют чаще всего, так как они позволяют легко изменять технологические условия и эффективно доставлять к растущим клеткам воздух, определяющий характер развития микроорганизмов и их биосинтетическую активность. В таких реакторах воздух подают в культуральную среду под давлением через разбрызгиватель - кольцо с множеством маленьких отверстий. При этом цели используют мешалки - одну или несколько. Мешалки, разбивая крупные пузырьки воздуха, разносят их по всему реактору и увеличивают время пребывания в культуральной среде. Эффективность распределения воздуха зависит от типа мешалки, числа оборотов, физико-химических свойств среды.
При интенсивном перемешивании культуральной среды происходит ее вспенивание, поэтому рабочий объем биореактора не превышает 70% общего объема. Свободное пространство над поверхностью раствора используется как буферное, где накапливается пена, и таким образом предотвращается потеря культуральной жидкости. В пенящейся жидкости условия аэрации лучше, чем в плотных растворах (при условии непрерывного перемешивания и циркуляции слоя пены, т.е. при исключении нахождения микроорганизмов вне культуральной жидкости). Вместе с тем вспенивание может привести к переувлажнению фильтров в отверстиях, через которые воздух выходит из биореактора, уменьшению потока воздуха и к попаданию в ферментер посторонних микроорганизмов.
Конструктивные особенности барботажных колонн и эрлифтных биореакторов дают этим типам ферментеров некоторые преимущества перед реакторами с механическим перемешиванием. Барботажные колонны более экономичны, так как перемешивание в них происходит восходящими потоками воздуха равномерно по всему объему. Отсутствие механической мешалки исключает один из путей проникновения в биореактор посторонних микроорганизмов. В барботажных биореакторах не возникает сильных гидродинамических возмущений (сдвигов слоев жидкости культуральной среды относительно друг друга).
Уменьшение сдвиговых факторов важно по следующим причинам: клетки рекомбинантных микроорганизмов менее прочны, чем нетрансформированные;
клетка отвечает на внешние воздействие уменьшением количества синтезируемых белков, в том числе рекомбинантных; под влиянием сдвиговых эффектов могут изменяться физические и химические свойства клеток, что затрудняет дальнейшую работу с ними (ухудшаются условия выделения, очистка рекомбинантных белков).
В барботажных колоннах воздух подают под высоким давлением в нижнюю часть биореактора; по мере подъема мелкие пузырьки воздуха объединяются, что влечет неравномерное его распределение. Кроме того, подача воздуха под высоким давлением приводит к сильному пе-нообразованию.
В эрлифтных биореакторах воздух подают в нижнюю часть вертикального канала. Поднимаясь, воздух увлекает за собой жидкость к верхней части канала, где расположен газожидкостный сепаратор (здесь частично выходит воздух). Более плотная деаэрированная жидкость опускается по другому вертикальному каналу ко дну реактора и процесс повторяется. Таким образом, в эрлифтном биореакторе культуральная среда вместе с клетками непрерывно циркулирует в биореакторе.
Эрлифтные биореакторы выпускаются в двух конструктивных вариантах. В первом - реактор представляет емкость с центральной трубой, которая обеспечивает циркуляцию жидкости (реакторы с внутренней циркуляцией). У эрлифтного биореактора второго типа культуральная среда проходит через отдельные независимые каналы (реактор с внешней системой циркуляции).
Эрлифтные биореакторы более эффективны, чем барботажные колонны, особенно в суспензиях микроорганизмов с большей плотностью или вязкостью. Перемешивание в эрлифтных ферментерах более интенсивно и вероятность слипания пузырьков минимальна.
Для стерилизации биореактора применяют пар под давлением. Внутри биореактора не должно быть «мертвых зон», недоступных для пара во время стерилизации. Стерилизации подлежат все клапаны, датчики, входные и выходные отверстия.
Стерильность обеспечивается и герметизацией биотехнологического оборудования, работающего в асептических условиях. Стерильная передача жидкости осуществляется через штуцеры парового затвора. Технологическая обвязка биореактора исключает контаминацию куль-туральной жидкости посторонней микрофлорой и возможности попадания продуктов биосинтеза в окружающую среду. Основные агенты, контаминирующие клеточные культуры — бактерии, дрожжи, грибы, простейшие, микоплазмы, вирусы. Источники контаминации - воздух, пыль, питательные среды, рабочие растворы, оборудование, рабочий персонал.
Очистка воздуха от микроорганизмов и аэрозольных частиц осуществляется через фильтры предварительной очистки (комбинированные глубинные фильтры - бумага, картон, тканевые материалы), которые устанавливают на всасывающей линии перед компрессором (воздух очищается от частиц размером более 5 мкм) и фильтры тонкой очистки (ткань ФП, удаляющая частицы размером до 0,3 мкм, металлокерамиче-ские и мембранные фильтры).
Металлокерамические фильтры изготовлены из калиброванных металлических порошков (бронзы, никеля, нержавеющей стали, титана) способами спекания, прессования, прокатки; размер пор варьирует от 2 до 100 мкм. Металлокерамические фильтры стерилизуют при температуре 150 °С 50 мин. Они стойки к действию сильных кислот, щелочей, окислителей, спиртов, могут использоваться при температуре от -250 °С до +200 °С.
Преимущество металлокерамических фильтрующих элементов -простота регенерации, большой срок работы (5-10 лет). В отличие от волокнистых, нетканных и фторопластовых фильтров, зернистые металлокерамические материалы имеют неизменную структуру, химически инертны, поддаются любым методам стерилизации, отличаются высокой механической прочностью, просты в изготовлении.
Мембранные фильтры патронного и кассетного типа несмотря на менее значительный срок службы (1 год) обладают высокой эффективностью, быстрой съёмностью, надёжны в работе. Отмечена способность рядом фильтрующих материалов, заряженных отрицательно, задерживать живые клетки, бактерии, вирусы, эритроциты, лимфоциты и тромбоциты. Частицы, размер которых меньше величины пор фильтрующего материала, остаются на фильтре, если дзета-потенциал (электрический потенциал) частиц и стенок пор фильтра имеет противоположные заряды. Это явление- наблюдается при использовании в качестве фильтрующих элементов мембран с соответствующими электростатическими свойствами. Выбор фильтрующего материала зависит от объекта фильтрации и дзета-потенциала суспендированных частиц.
Отработанный воздух, отводимый из лабораторных и производственных помещений, контролируется на чистоту (отсутствие микроорганизмов).
Для обслуживания установок глубинного культивирования применяют автоматизированную модульную систему, включающую:
-очистку и стерилизацию воздуха и пара с использованием металлокерамических и титановых фильтрующих элементов;
-модули технологической обвязки, содержащие автономную систему термостатирования, запорную и регулирующую арматуру, индивидуальные входные и выходные фильтры, электропнев-мообразователи и другие регулирующие устройства;
-блок автоматического контроля и управления, содержащий программное устройство, преобразователи сигналов от измерительных электродов, газоанализаторы для измерения О2, СО2, еН, температуры, рСО2, рО2;
-системы цифровой и диаграммной индикации текущих параметров культивирования.
Установки глубинного культивирования снабжены блоками дистанционного измерения давления в биореакторе и его рубашке, блоками дистанционного контроля интенсивности аэрации воздухом или газовой смесью (кислорода и азота, кислорода и углекислого газа, воздуха и углекислого газа, азота и углекислого газа).
Блок автоматического управления позволяет контролировать и поддерживать на заданном уровне программную стерилизацию биореактора и арматуры, скорость вращения мешалки и дистанционный контроль открытия или закрытия вентилей и регулирующих клапанов.
Ряд стран специализируется на выпуске широкого ассортимента оборудования для культивирования различного назначения (фирма NBS - США; Полиферм, Биотек - Швеция; Марубиши - Япония; LН - Фер-ментейшн — Великобритания; Браун - Германия; БИОР-0,1, БИОР-0,2 — Россия, институт биологического приборостроения с опытным заводом АН РФ).
Дата добавления: 2016-02-24; просмотров: 1833;
