Химические свойства.
Оксокислоты проявляют свойства, характерные для карбоксильной и карбонильной групп. Причем оксокислоты - более сильные кислоты, чемгидроксикислоты, легко подвергаются декарбоксилированию с образованием карбонильных соединений:
CH3-CO-CH2-COOH → CH3-CO-CH3 + CO2 .
ß-Оксокислоты и их эфиры обладают специфическими свойствами, которые связаны с их повышенной СН-кислотностью.
ß-оксокислоты существуют в виде двух таутомерных форм: кетонной и енольной, причем содержание енольной формы в равновесной смеси значительное (кето-енольная таутомерия). Енольные формы дополнительно стабилизируются за счет образования внутримолекулярной водородной связи. Например, кето-енольные формы ацетоуксусного эфира:
92,5% кетоформа 7,5% енольная форма
и щавелевоуксусной кислоты:
ЛЕКЦИЯ № 14.
УГЛЕВОДЫ
План
1. Классификация углеводов.
2. Моносахариды. Состав, свойства.
3. Дисахариды. Состав, свойства.
4. Полисахариды. Состав, свойства.
Углеводами называются соединения с общей формулой Сn (Н2О) m, где n ≥ 4. Углеводы широко распространены в животном и растительном мире, они играют важную роль во многих жизненных процессах. До 80% сухого вещества растений приходится на углеводы, до 2% сухого вещества - в животных организмах.
В растениях углеводы образуются в результате фотосинтеза в зеленом листе:
hν
6СО2 + 6Н2О → С6Н12О6 + 6О2
хлорофилл
Организм животных и человека неспособен синтезировать углеводы, поэтому удовлетворяет потребность в них с различными пищевыми продуктами растительного происхождения (в сутки взрослому человеку необходимо 400-500г углеводов).
Углеводы делятся на два вида: простые или моносахариды, монозы (не подвергаются гидролизу) и сложные - ди-, олиго- и полисахариды (способны гидролизоваться до моносахаридов).
Моносахариды являются гетерофункциональными соединениями, в молекулах которых содержатся карбонильная группа (альдозы и кетозы) и несколько гидроксильных групп. По числу атомов углерода в составе моноз выделяют триозы (3 атома углерода), тетрозы, пентозы, гексозы. Например, альдопентоза или кетопентоза, альдогексоза или кетогексоза.
В основу наименований моносахаридов в большинстве случаев положены тривиальные названия, которые имеют окончание - оза.
Для углеводов характерны особенности в строении, следовательно, и в свойствах.
В молекуле моносахарида имеется несколько асимметрических атомов углерода, поэтому для них характерна оптическая изомерия - наличие антиподов, диастереоизомеров, которые можно представить в виде проекций Фишера. Общее число стереоизомеров (N) определяют по формуле: N= 2n, где n - число асимметрических атомов углерода.
Принадлежность моносахаридов к D- или L-ряду определяется по расположению ОН-группы у последнего асимметрического атома углерода. Если эта группа расположена справа относительно углеродного скелета, что соответствует стандарту - D-глицериновому альдегиду (см. «Изомерия»), то моносахариды относятся к D-ряду, если слева - к L- ряду:
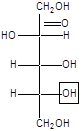
D-фруктоза L-фруктоза
Природные монозы, за редким исключением, являются представителями D-ряда.
Эпимеры - оптические изомеры (диастереомеры), отличающиеся положением гидроксильной группы у одного асимметрического атома углерода:
эпимер D-фруктозы - D-псикозаэпимер L-фруктозы - L-псикоза
Углеводам присуще явление таутомерии - подвижного равновесия открытой ﴾оксикарбонильной﴿ и циклической ﴾полуацетальной﴿форм.
В циклической форме атом углерода с полуацетальным гидроксилом становится асимметрическим и поэтому его пространственное строение дает два изомера - α- и β-формы.
Образование циклических форм происходит за счет присоединения спиртового гидроксила у 4-го или 5-го атома углерода к карбонильной группе углевода, при этом образующаяся пятичленная циклическая форма называется фуранозной, шестичленная - пиранозной. При углероде карбонильной группы появляется новый гидроксил (ОН) - гликозид или полуацетальный:
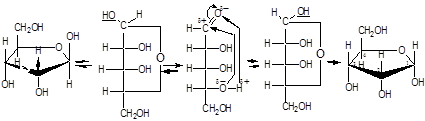
ß,D-рибофураноза α,D-рибофураноза
α- и β - формы являются диастереомерами (аномеры). Уα-формы гликозид и гидроксил у последнего асимметрического атома углерода расположены по одну сторону углеродной цепи, а у β-формы - по разные стороны:
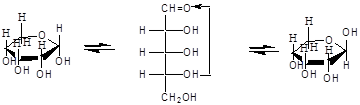
α, D-рибопираноза D-рибоза ß,D-рибопираноза
Название циклических форм углеводов составляют согласно схеме - корень углевода + название цикла(5-членный - фуран, 6-членный - пиран) + окончание -оза:рибофураноза и рибопираноза.
Переход аномеров из одной формы в другую (α  β) называется мутаротацией. Поскольку моносахариды в растворах существуют в двух таутомерных формах, то в зависимости от реагентов и условий в реакцию вступает одна из форм. Открытая форма моносахаридов легко вступает в реакции по карбонильной группе (окисление, восстановление, нуклеофильное присоединение и т.д.) (см. «Альдегиды и кетоны»).
β) называется мутаротацией. Поскольку моносахариды в растворах существуют в двух таутомерных формах, то в зависимости от реагентов и условий в реакцию вступает одна из форм. Открытая форма моносахаридов легко вступает в реакции по карбонильной группе (окисление, восстановление, нуклеофильное присоединение и т.д.) (см. «Альдегиды и кетоны»).
Циклическая форма моноз в реакциях проявляет свойства многоатомных спиртов (образование солей, простых и сложных эфиров, окисление, дегидратация) (см. «Многоатомные спирты»). При этом полуацетальный гидроксил наиболее активен и при взаимодействии со спиртами образует полуацетали, которые в классе углеводов называются гликозидами (природные гликозиды: солонин, амигдалин, сердечные гликозиды и т.д.).
Дисахариды (биозы) классифицируют на восстанавливающие и невосстанавливающие. Восстанавливающие дисахариды образуются за счет полуацетального гидроксила одной молекулы монозы и любого другого спиртового гидроксила (гликозид-гликозная связь) другой молекулы:
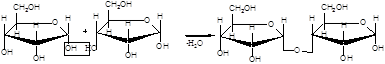
α,D-рибофураноза 3(α,D-рибофуранозидо)α,D-рибофураноза
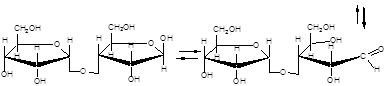
3(α,D-рибофуранозидо)β,D-рибофураноза
В полученных дисахаридах остается один свободный полуацетальный гидроксил, за счет которого в водных растворах возможно существование таутомерных форм, т.е. восстанавливающие дисахариды в водном растворе мутаротируют.
Восстанавливающие дисахариды, как и моносахариды, легко вступают в реакции по карбонильной группе (окисление, восстановление, нуклеофильное присоединение и т.д.).
Невосстанавливающие дисахариды образуются в результате взаимодействия полуацетальных гидроксилов двух молекул моноз (гликозид-гликозидная связь):
α,D-рибофураноза 1(α,Dрибофуранозидо)α,D-рибофуранозид
В полученном дисахариде отсутствует полуацетальный гидроксил, поэтому углевод в водном растворе не образует таутомерных форм (не мутаротирует). Такие дисахариды проявляют свойства только многоатомных спиртов.
Полисахариды (полиозы) образуются из моносахаридов в циклической форме. Относятся они к невосстанавливающим углеводам и дают реакции только в циклической форме подобно многоатомным спиртам. Важнейшими полисахаридами являются крахмал, целлюлоза, гликоген, построенные из фрагментов D-глюкозы. В растениях встречаются и другие полисахариды, содержащие фрагменты D-галактозы, D-маннозы, D-фруктозы и т.д.
Крахмал - запасный углевод растений, накапливается в зернах и клубнях растений. Крахмал состоит из двух полисахаридов - амилозы и амилопектина. Амилоза - биополимер неразветвленного строения, построен из остатков α,D-глюкозы. Амилопектин построен также из остатков α,D-глюкозы, но имеет разветвленную макромолекулу (ответвление у шестого атома углерода остатка α,D-глюкозы). Крахмал широко применяется в различных отраслях промышленности. Из него получают сироп и глюкозу, он является главной составной частью пищевых продуктов (хлеб, крупа, мука, картофель, кукуруза). Из крахмала в ферментативных процессах получают этиловый и бутиловый спирты, молочную и лимонную кислоты и др. Используют крахмал в текстильной промышленности и для получения клеев и красок.
Гликоген («животный крахмал») запасный полисахарид животных, накапливается в печени, мышцах, по строению сходен с амилопектином, но имеет более разветвленную структуру.
Целлюлоза - полисахарид, содержащийся в растениях (чистая целлюлоза - хлопок, вата, фильтровальная бумага) и состоящий из остатков β,D-глюкозы. Используют целлюлозу для получения бумаги, фотопленок, цветных лаков, искусственных волокон (вискоза, ацетатный шелк и др.), взрывчатых веществ, спиртов и т.д.
Крахмал, гликоген расщепляются ферментами, например желудочно-кишечного тракта, целлюлоза - только бактериями (почвенные, желудочно-кишечного тракта, грибы и т.д.), которые гидролизуют и окисляют целлюлозу до углекислого газа, завершая таким образом круговорот органического углерода на Земле.
Знаете ли вы, что
-В 1844 году К. Шмидт назвал эти соединения углеводами (гидраты углерода).
-D(-)-фруктоза или левулоза (laevus - левый), плодовый сахар, содержится во фруктах, овощах, пчелином меде (до50%), входит в состав сахарозы. Фруктоза - самый сладкий углевод, в 2 раза слаще сахарозы, в 4 раза - глюкозы.
-D(+) глюкоза или декстроза (dexter - правый), виноградный сахар, содержится в ягодах, фруктах, является структурной единицей сахарозы, крахмала, целлюлозы, гликогена, в крови человека содержится около 0,1% глюкозы. Глюкоза широко используется в пищевой промышленности, медицине, является сырьем для получения глюконовой и аскорбиновой кислот, этилового спирта.
-Ксилоза (древесный сахар) входит в состав полисахаридов ксиланов, содержащихся в древесине, лузге подсолнуха, кукурузных кочерыжках, соломе.
-Рибоза и 2-дезоксирибоза (фуранозные формы) входят в состав нуклеиновых кислот - РНК и ДНК.
-L-сорбоза - кетогексоза, содержится в природных продуктах, является исходным веществом для синтеза L-аскорбиновой кислоты (витамина С), которая содержится во многих фруктах и овощах, необходима для жизнедеятельности организма человека и животных.
-Сахароза - тростниковый сахар, получали его в глубокой древности (300 лет до н.э.) в Индии. В Европу и страны Карибского моря сахар завезли в 16 веке.
-В 1747 году Андреас Сигизмунд Марграфф обнаружил кристаллы сахара в свекольном соке.
-В 1840 году во Франции сахар получили из свеклы (свекловичный сахар), который к концу 19 века вытеснил тростниковый. В России в 1902 году был построен первый сахарный завод, к 1914 году таких заводов было около 300.
-В 1953 году французским химиком Р. Лемье впервые в лабораторных условиях осуществлен синтез сахарозы.
-Лактоза (молочный сахар) построена из галактозы и глюкозы, обладает в 5 раз меньшей сладостью по сравнению с сахарозой, содержится в молоке.
-Содержание крахмала в зернах злаковых растений велико, например в зернах риса - до 86%, пшеницы - до75%, кукурузы - до 72%, в клубнях картофеля - до 24%.
-Содержание целлюлозы в древесине 40-50%, соломе - около 30%, большее количество - в волокнах хлопчатника, джута и конопли.
-Хитин - аминополисахарид, главный компонент внешнего скелета насекомых и ракообразных.
- Про восстановлении моноз образуются многоатомные спирты (из глюкозы - сорбит, ксилозы - ксилит) - заменители сахара.
ЛЕКЦИЯ № 15.
АМИНЫ
План
1. Классификация, номенклатура аминов.
2. Алифатические амины. Состав, строение, изомерия, свойства.
3. Ароматические амины.
Амины - производные аммиака, в молекуле которого атомы водорода замещены на углеводородные радикалы алифатического (R) или ароматического ряда (Ar).
В зависимости от числа углеводородных радикалов, связанных с атомом азота, различают первичные (-NH2), вторичные(-NH-) и третичные амины ( >N-).
Алифатические амины: R-NH2, R1-NH-R2, R1-N(R)2.
Ароматические амины: Ar-NH2, Ar-NH-Ar, (Ar)3 N.
Жирноароматические амины: Ar-NH- R.
Номенклатура.Названия аминов образуются из названий углеводородных радикалов и слова амин:
CH3-NH2 CH3-NH-CH3 CH3-CH2-CH(NH2)-CH2-CH2-CH3
метиламин диметиламин 3-гексиламин (3-аминогексан)
Для некоторых ароматических аминов сохраняются тривиальные названия:
анилин п-толуидин бензиламин N-метиланилин
Изомерия.Для аминов характерна, в основном, структурная изомерия. Для алифатических аминов:
а) изомерия углеродного скелета (на примере С3Н9N)
пропиламин изопропиламин
б) метамерия
триметиламин
Для ароматических аминов - различное расположение радикалов и аминогруппы в бензольном кольце. Например,
п-метиланилин N-метиланилин бензиламин
п-толуидин
Нахождение в природе.Природные амины животного происхождения: адреналин, норадреналин, серотонин, гистамин, тирамин - участвуют в регуляции центральной нервной, пищеварительной, эндокринной, сердечно-сосудистой и других систем.
Амины растительного происхождения - алкалоиды, характеризующиеся высокой физиологической активностью.
Получение.
1. Алкилирование аммиака и аминов (реакция Гофмана). Алкилирующие агенты: галогенопроизводные углеводородов, спирты.
2. Восстановление азотсодержащих органических соединений.
Нитросоединения, оксимы, нитрилыв присутствии катализаторовмогут быть восстановлены до аминов.
R-NO2 + [H] → R-NH2
3. Для получения алкиламинов разработано множество специальных методов, например расщепление амидов карбоновых кислот галогенами в щелочной среде (перегруппировка Гофмана):
4. Восстановление ароматических нитросоединений (реакция Зинина):
Строение.Атом азота в алкиламинах находится в sр3-гибридизации, ковалентная Ϭ-С-N-связь образована перекрыванием sр3 (С) – sр3 ( N) - орбиталей, дипольный момент этой связи отличен от нуля. Аминогруппа в алкиламинах обладает электроноакцепторным характером по отношению к углеводородному радикалу (-I- эффект): Rδ+ → NН2 δ-. Алкиламины образуют межмолекулярные водородные связи:
.
Пространственная форма аминов представляет собой искаженный тетраэдр.
В ароматических аминах атом азота находится в состоянии sр2- гибридизации, неподеленная электронная пара азота участвует в р,π - сопряжении с бензольным кольцом  (-I,+М).
(-I,+М).
Таким образом, аминогруппа в ароматических аминах проявляет электронодонорные свойства, в результате этого электронная плотность на атоме азота понижается, в орто- и пара- положениях кольца электронная плотность увеличивается.
Физические свойства аминов. Ассоциация молекул первичных и вторичных алкиламинов обусловливает более высокие температуры кипения и плавления по сравнению с близкими по массе углеводородами. Однако по сравнению со спиртами амины имеют более низкие значения температур плавления и кипения, что связано с образованием аминами менее прочных водородных связей. Низкомолекулярные амины смешиваются с водой в любых соотношениях благодаря образованию водородных связей. Ароматические амины - это жидкие или твердые вещества с характерными запахами, плохо растворимые в воде.Химические свойства.Химическое поведение аминов определяется главным образом присутствием неподеленной электронной пары у атома азота.
а) Основные и кислотные свойства.Основные свойства аминов обусловлены наличием неподеленной электронной пары у атома азота аминогруппы и зависят от природы и числа радикалов в их составе. Увеличиваются основные свойства в следующем направлении:
ароматические амины < аммиак < алифатические амины.
Уменьшение основности ароматических аминов по сравнению с алифатическими (почти в миллион раз) связано со значительной делокализацией неподеленной электронной парой атома азота. При этом электронодонорные заместители кольца увеличивают основные свойства, электроноакцепторные - уменьшают. Так, пара-метиланилин более сильное основание по сравнению с пара-нитроанилином:
Амины как основания легко присоединяют протон с образованием солей:
СН3NH2 + HCl → СН3NH3+ Cl -..
метиламин хлорид метиламмония
анилин хлорид фениламмония
Аммонийные соли неустойчивы, особенно в ароматическом ряду, и способны разлагаться в присутствии щелочей:
СН3NH3+ Cl - + NаОН → СН3NH2 + NаCl.
Водные растворы алифатических аминов имеют щелочную реакцию:
СН3NH2 + HОН → СН3NH3 ОН ↔ СН3NH3+ + ОН-
гидроксид метиламмония
Первичные и вторичные алифатические амины являются слабыми N-H кислотами (рКа=33-35). При взаимодействии с активными металлами образуют соли﴾амиды﴿:
RNH2 + Na → RNH- Na+ + 1/2 H2
б) Нуклеофильные свойства.Нуклеофильные свойства амины проявляют в реакциях нуклеофильного замещения (SN) и нуклеофильного присоединения (АN).
1. Нуклеофильное замещение (SN):
Алкилирование аминов
Амины алкилируются спиртами, галогенпроизводными углеводородов:
С2Н5 ОН + СН3NН2 → С2Н5-NН-СН3 + НОН
Ацилирование аминов
Амины ацилируются карбоновыми кислотами и их производными с образованием амидов карбоновых кислот:
В результате сопряжения неподеленной электронной пары атома азота с карбонильной группой (р,π-сопряжение) основные и нуклеофильные свойства аминогруппы в амидах слабо выражены.
2. Нуклеофильное присоединение (АN):
Дата добавления: 2016-02-20; просмотров: 2683;
