Белки как коллоиды.
Все животные и растительные ткани состоят из различных химических соединений: белков, углеводов, жиров и витаминов. И хотя все эти вещества необходимы для нормального развития организма, наибольшее значение имеют белки. Именно они служат той основной материей, из которой состоят все части отдельной клетки и целого организма. Белки являются высшей ступенью развития материи и с ними неразрывно связаны все неисчислимо многообразные проявления жизни, начиная с простейших функций самых примитивных существ и кончая сложнейшими функциями человеческой деятельности.
Строение белка. Различают белки простые и сложные. Простой белок в настоящее время рассматривается как продукт поликонденсации аминокислот, т. е. как природный полимер. Сложные белки состоят из простого белка и небелковых компонентов — углеводов, липидов, нуклеиновых кислот и других соединений.
Общим для всех белков является то, что их макромолекулы состоят из многих сотен звеньев, соединенных между собой так называемой пептидной связью, имеющей строение
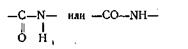
По своей природе каждое звено - остаток одной из аминокислот. Они образуют полипептидные цепи, из которых каждая содержит десятки и даже сотни остатков различных аминокислот. Все другие аминокислоты, входящие в состав белка, относятся к α-аминокислотам, у которых аминогруппа NH2 связана с тем же атомом углерода, с которым связана и карбоксильная группа СООН. Все a-аминокислоты (за исключением гетероциклических) могут быть выражены общей формулой
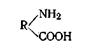
где R — углеводородный радикал.
Аминокислоты отличаются друг от друга не только величиной, но и числом входящих в них групп NH2 и СООН, а также наличием в их составе атомов других элементов, таких, как S, Вг, I. В настоящее время открыто около 26 различных аминокислот, входящих в состав белков. Примерно половина этого количества содержит лишь по одной группе NH2 и СООН; они являются простыми, или моноаминокислотами. Другие содержат две группы СООН на одну аминогруппу и обладают характерными кислыми свойствами. Третья группа аминокислот обладает явно выраженными основными свойствами, она содержит одну группу СООН нa две аминогруппы. Кроме того, в состав белков входят несколько циклических аминокислот, более сложных по составу и структуре их радикала R.
Впервые наиболее простая схема строения белка была дана Фишером (1906) в виде полипептидной цепочки.
Реакции поликонденсации протекают по следующему уравнению
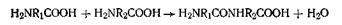
Именно с помощью полипептидной связи идет дальнейшее образование полимеров белков любой сложности. По мере увеличения числа аминокислотных звеньев в молекулах полипептидов возрастает и количество возможных изомеров. Так, английский биохимик Ричард Синдж подсчитал, что белок с молекулярной массой 3400 (сравнительно короткоцепочечный), в каждой молекуле которого содержится 288 аминокислотных остатков, а в состав входит лишь 12 аминокислот, может иметь совершенно астрономическое число изомеров — 10300. Если бы можно было собрать воедино лишь по одной молекуле каждого из возможных изомеров этого гипотетического белка, то общая масса этих молекул составила бы 10277 кг. Поскольку масса Земли исчисляется значительно меньшей цифрой— 1024 кг,— совершенно очевидно, что реально в природе существует лишь несколько изомеров этого белка.
Количество белков, встречающихся в природе, чрезвычайно велико. В настоящее время в чистом виде выделено несколько сот различных белков. Причем исследования показали, что общее число белков, отличающихся друг от друга по своим химическим свойствам, в любом живом организме достигает нескольких тысяч. Часто даже внешне совершенно идентичные белки из разных источников не всегда оказываются одинаковыми по составу и структуре. Итак, все многообразие форм жизни на нашей планете обусловлено существованием нескольких миллионов отдельных белков, каждый из которых в своем роде уникален.
Белковая макромолекула представляет собой очень сложный комплекс. Повторяющимися звеньями его являются так называемые микромолекулы, в состав каждой из которых входит пептидная цепочка из 4—6 аминокислот и циклическое образование (дикетопиперазиновое кольцо).
Таким образом, белки по составу представляют собой сложные полипептиды, а по строению — высокополимеры (высокополиконденсаты).
Как показали многочисленные исследования, не только аминокислоты имеют в полипептидной цепи каждая свое место, но и сами цепи в белках расположены в строго определенном порядке. Достаточно нарушить расположение цепей в молекуле, как белок изменится и погибнет. Наряду с пептидной связью внутри белковой молекулы имеются и другие виды связи, в частности, водородная. В результате этого макромолекула белка в своей основе приобретает характер очень прочного образования.
Многочисленными исследованиями установлено, что все белки по форме их макромолекул могут быть подразделены в основном на две группы — фибриллярные и глобулярные.
Фибриллярные, или волокнистые, белки (от латинского слова fibrilla — волокно) состоят из макромолекул в виде тонких вытянутых нитей, обычно соединенных между собой. В эту группу входят белки, являющиеся составными частями кожи и сухожилий (коллаген, желатин), волоса и рога (кератин), мышц (миозины) и др. В организме они выполняют в основном механические функции, хотя некоторые из фибриллярных белков обладают и биологической активностью. Так, названный выше миозин является ферментом; он расщепляет аденазинтрифосфорную кислоту (АТФ), которая обладает большим количеством энергии, выделяемой при ее расщеплении.
Фибриллярные белки при комнатной температуре обычно нерастворимы в воде, однако способны набухать в ней, что говорит об их гидрофильных свойствах.
Глобулярные белки (от латинского слова globula — шарик) состоят из макромолекул шаровидной, эллипсовидной, реже веретенообразной формы. Характерной особенностью этих белков является хорошая растворимость в воде, т. е. высокая гидрофильность. Глобулярные белки находятся главным образом в биологических жидкостях: в крови, лимфе, протоплазме клеток. Белки этой группы — альбумины, а также глобулины яичного белка, молока, сыворотки крови, пепсин желудочного сока и другие — выполняют в организме очень важные биологические функции.
Многочисленные эксперименты показали, что характер связей в фибриллярных и глобулярных белках одинаков. Молекулярная масса обоих основных структурных видов белка также примерно одинакова (от 30 000 до 1 000 000 и более), но форма значительно отличается. Так, у фибриллярных белков длина макроглобул в сотни и тысячи раз превышает их толщину. Например, макроглобула проколлагена с молекулярной массой 680 000 имеет длину около 30 нм, а толщину — всего лишь несколько десятков нанометров.
белковых глобул. Для устойчивости коллоидных частиц имеет значение только вода, создающая внешнюю водную оболочку. Именно она и препятствует столкновению и объединению белковых макромолекул.
Сложные белки состоят из макроглобулы простого белка, к которой присоединены другие компоненты: углеводы или липиды, фосфорная кислота и т. п. К этой группе относятся также и нуклеопротеиды, строение которых особенно интенсивно изучается в последнее время. Напомним, что нуклеопротеиды состоят из белка и так называемой нуклеиновой кислоты, которая представляет собой полимер, состоящий из мононуклеотидов (мономеров), соединенных между собой сложноэфирными связями. Каждый из мономеров является одним из пуриновых (аденин или гуанин) или пиримидиновых (тимин, цитозин или урацил) оснований, соединенных через рибозу или дизоксирибозу с фосфорной кислотой. Особое значение придают в биологических Электрический заряд белков, помимо их своеобразного строения, является особенностью их свойств. В белковой молекуле содержатся две полярные группы: основная — NH2 и кислотная — СООН, которые и сообщают макромолекуле амфотерные свойства. Белки не просто электролиты, а электролиты — амфолиты. Это означает, что в водных растворах макромолекулы способны диссоциировать как кислоты, т. е. с отщеплением ионов водорода
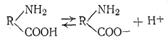
и как основания, т. е. с отщеплением ионов гидроксила
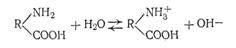
Макромолекулы белков имеют спиралевидную конфигурацию, которая может изменяться в зависимости от знака их заряда. Так, в нейтральном состоянии белка противоположно заряженные ионы NH3+ и СОО- испытывают сильное притяжение друг к другу и тем самым вызывают укорачивание белковой нити и даже скручивание ее в виде спирали:
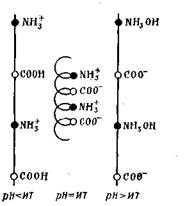
В кислой и щелочной среде происходит отталкивание отдельных групп и растягивание цепи в целом, т. е. раскручивание спирали.
Таким образом, заряд белка зависит от соотношения в его молекулах карбоксильных и аминных групп и от рН среды. Значение рН раствора белка, при котором белок становится электронейтральным, называется изоэлектрической точкой данного белка. Каждый белок имеет свое значение рН, при котором он находится в изоэлектрическом состоянии (Табл.6.5).
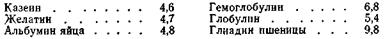
Таблица 6.5 Опыт показывает, что в изоэлектрическом состоянии вязкость белков наименьшая. Это связано с изменением формы макромолекул, так как макромолекулы в развернутом состоянии придают растворам более высокую вязкость, чем макромолекулы, свернутые в спираль или клубок.
Экспериментальное определение изоэлектрической точки белковых растворов, как и определение изоэлектрического состояния лиофобных золей, может быть произведено прямым или косвенным методами.
Прямые методы сводятся к наблюдению за поведением частиц в электрическом поле при электрофорезе. При этом исследуемый белок подвергают электрофорезу в буферных растворах с разными значениями рН. В буферном растворе со значением рН, равным изоэлектрической точке белка, последний электронейтрален и не перемещается в электрическом поле. Эти наблюдения проводят либо макроскопически в особых электрофоретических аппаратах, либо микроскопически в кювете ультрамикроскопа. Помимо прямых методов наблюдения изоэлектрического состояния белков существуют и косвенные методы, которые сводятся к наблюдению максимума или минимума того или иного физического свойства, изменяющегося с изменением дзета-потенциала испытуемого раствора. Все эти методы подробно описаны в соответствующих руководствах.
Дата добавления: 2016-02-20; просмотров: 2873;
