Коагуляция гидрофобных золей электролитами.
Коллоидные системы, как известно, обладают высокоразвитой поверхностью раздела и большим избытком свободной поверхностной энергии. Поэтому эти системы термодинамически неустойчивы и имеют тенденцию к самопроизвольному уменьшению межфазной энергии. Это в большинстве случаев происходит за счет уменьшения суммарной поверхности частиц дисперсной фазы золей. Если в силу создавшихся условий мицеллы золя приходят в тесное соприкосновение между собой, они соединяются в более крупные агрегаты. Это процесс коагуляции (от латинского coagulatio — свертывание, створаживание).
Процесс осаждения укрупненых частиц твердой фазы золя называется седиментацией (от латинского sedimentation — осаждение).
Процесс коагуляции всегда связан с уменьшением степени дисперсности и обусловлен агрегативной неустойчивостью коллоидных систем. В коагуляции принято различать две стадии: скрытую коагуляцию, когда невооруженным глазом еще нельзя наблюдать какие-либо внешние изменения в золе, и явную коагуляцию, когда процесс агрегации частиц дисперсной фазы золя может быть легко обнаружен визуально.
Лиофобные золи характеризуются сравнительно короткой стадией скрытой коагуляции; для высокомолекулярных соединений период скрытой коагуляции может быть продолжительным. Часто скрытый период коагуляции в растворах высокомолекулярных соединений совсем не переходит в явную форму или заканчивается студнеобразованием.
Факторы коагуляции коллоидных систем бывают весьма разнообразными. Коагуляция может быть вызвана повышением температуры, длительным диализом, добавлением электролитов, разного рода механическими воздействиями (размешиванием, встряхиванием, взбалтыванием), сильным охлаждением, ультрацентрифугированием, концентрированием, пропусканием электрического тока, а также действием на данный золь других золей. В ряде случаев коагуляция может происходить в результате химических реакций, протекающих в золях (явление старения).
Наиболее важным и наиболее изученным фактором коагуляции гидрофобных золей является действие электролитов. Практически все электролиты, взятые в достаточном количестве, способны вызывать коагуляцию коллоидных растворов.
Чтобы начался процесс коагуляции, нужно наличие некоторой минимальной концентрации электролита в золе. Наименьшая концентрация электролита, вызывающая коагуляцию, получила название порога коагуляции и выражается в ммоль/л. Обычно порог коагуляции определяют по помутнению коллоидного раствора, по изменению окраски и по другим признакам.
Опытом установлено, что коагулирующее действие обычно оказывает ион, заряд которого по знаку противоположен заряду поверхности коллоидных частиц. Так, для положительно заряженных золей коагулирующим ионом электролита являются анионы, а для отрицательных — катионы. Коагулирующее действие электролита сильно возрастает с увеличением зарядности иона-коагулятора. Иными словами, ионы-коагуляторы высшей зарядности вызывают явную коагуляцию при значительно меньших концентрациях, чем ионы низшей зарядности (правило Шульце—Гарди)
Так, для катионов К+, Ва2+, А13+ отношение порогов коагуляции их хлоридов при действии на отрицательно заряженный золь As2S соответственно равно CКСl:СВаС12:САlС13= =49,5:0,69:0,093 (ммоль/л) или, принимая порог коагуляции иона алюминия за единицу CK+:CBa2+:CАl3+=540:7,4:1.
В случае коагуляции положительно заряженного золя гидроксида железа Fe(OH)3 для анионов-коагуляторов Сl- и SO42- отношение порогов коагуляции калийных солей CCl- :CSO42- = 9,0 : 0,205 или округленно CCl- :CSO42- = 44:1.
Правило Шульце—Гарди носит приближенный характер, так как коагулирующее действие электролита зависит не только от зарядности его ионов. Некоторые органические однозарядные основания, например катионы морфина, обладают более сильным коагулирующим действием, чем двухзарядные ионы. Подобное явление объясняется тем, что большие органические ионы обладают более сильной адсорбируемостью, т. е. они гораздо легче входят во внутреннюю часть двойного электрического слоя, образованного вокруг коллоидного ядра.
Пороги коагуляции ионов одного и того же знака и зарядности отличаются друг от друга. Здесь сказывается влияние не только размера ионов, но и степень их гидратации. По величине коагулирующей способности ионы щелочных металлов можно расположить в следующий ряд:
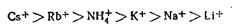
Анионы можно расположить в соответствующий ряд:
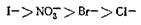
Такого типа ряды известны и для щелочноземельных металлов. Эти ряды ионов получили название лиотропных рядов.
Как показывает опыт, коагуляции гидрофобных золей можно вызвать и при помощи смеси электролитов. При этом возможны три случая: 1) коагулирующее действие смешиваемых электролитов суммируется; 2) коагулирующее действие смеси электролитов меньше, чем в случае чистых электролитов. Это явление носит название антагонизма ионов. Оно характерно для смесей ионов, имеющих различную валентность; 3) в ряде случаев имеет место взаимное усиление коагулирующего действия смешиваемых ионов. Это явление называется синергизмом ионов.
Помимо электролитов, коагуляция гидрофобных коллоидов может быть вызвана смешиванием в определенных количественных соотношениях с другим гидрофобным золем, гранулы которого имеют противоположный знак. Это явление носит название взаимной коагуляции; оно может рассматриваться как частный случай электролитной коагуляции. Так, положительно заряженный золь Fe(OH)3 может быть скоагулирован путем прибавления отрицательно заряженного золя As2S3. .
Явление взаимной коагуляции золей имеет чрезвычайно широкое распространение в природе и в целом ряде технологических процессов. Так, взаимная коагуляция происходит при смешении морской и речной воды. При этом ионы солей морской воды адсорбируются на заряженных коллоидных частицах речной воды, в результате чего происходит их коагуляция. По этой причине на дне постепенно скапливаются большие количества ила, река мелеет, образуется множество мелей и островков.
С явлениями взаимной коагуляции мы часто встречаемся в быту. Чернила представляют собой коллоидные растворы различных красителей. Причем в разных чернилах коллоидные частицы заряжены по-разному. Вот почему при смешении разных чернил имеет место взаимная коагуляция.
На явлении взаимной коагуляции основана очистка питьевой воды. Исследования показали, что при добавлении к очищаемой воде раствора A12(SO4)3 в течение примерно первых 30 с в результате гидролиза коагулянта образуется коллоидный гидроксид алюминия Аl(ОН)3. Он обладает громадной суммарной поверхностью, на которой происходит
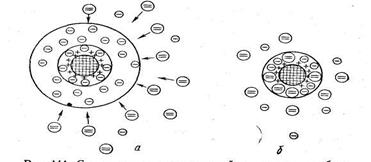 Рис.6.14
Рис.6.14
адсорбция коллоидных примесей очищаемой воды. Тушь при температуре ниже нуля портится — коагулирует, так как вода замерзает и коллоидные частицы сажи, лишаясь защитной гидратной оболочки, необратимо коагулируют.
Механизм электролитной коагуляции. Как известно, гидрофобные коллоиды неустойчивы в изоэлектрическом состоянии, т. е. электронейтральные частицы коагулируют с наибольшей скоростью. На рис. 6.18 показана схема снятия заряда с коллоидной частицы при добавлении электролита с двухзарядными анионами. Как видим, гранула становится электронейтральной в том случае, если противоионы диффузного слоя, заряженные отрицательно, перемещаются в адсорбционный слой. Чем выше концентрация прибавляемого электролита, тем сильнее сжимается диффузный слой, тем меньше становится дзета-потенциал и, следовательно, тем быстрее начинается процесс коагуляции. При определенной концентрации электролита практически все противоионы перейдут в адсорбционный слой, заряд гранулы снизится до нуля и коагуляция пойдет с максимальной скоростью, так как отсутствие диффузного слоя обусловит значительное понижение давления расклинивания.
Коагулирующее действие электролитов не сводится только к сжатию диффузного слоя. Как показали многочисленные исследования, одновременно протекает избирательная адсорбция на коллоидной частице тех ионов электролита, которые имеют заряд, противоположный грануле. Причем чем выше заряд иона, тем интенсивнее он адсорбируется. Накопление ионов в адсорбированном слое сопровождается уменьшением не только дзета-потенциала, но и диффузного слоя (рис. 6.18).
При коагуляции золей электролитами имеет место также и процесс ионообменной адсорбции. При этом ионы добавляемого электролита обмениваются на одноименно заряженные противоионы адсорбционного слоя. Если ионы добавляемого электролита имеют большую зарядность по сравнению с одноименно заряженными противоионами, такая замена приводит к довольно значительному понижению дзета-потенциала.
Из всего вышесказанного не следует делать вывод о том, что основная причина коагуляции заключается в достижении некоторого постоянного для всех случаев критического дзета-потенциала.
Когда расстояние между мицеллами становится меньше 10-9—10-10 м, , достигает нулевого значения дзета-потенциала наступает коагуляция. Рис.6.15
 В ряде случаев при добавлении к золям электролитов с многозарядными ионами, заряд которых противоположен по знаку заряду коллоидных частиц, может наблюдаться не коагуляция, а стабилизации золя и перемена знака дзета-потенциала. Это явление получило в коллоидной химии название перезарядки золей. Так, при добавлении к золю платины небольших количеств хлорида железа FeCl3 наблюдается понижение отрицательного заряда коллоидных частиц платины и их коагуляция. Дальнейшее увеличение концентрации FeCl3 приводит к перезарядке коллоидных частиц платины; они получают положительный заряд.
В ряде случаев при добавлении к золям электролитов с многозарядными ионами, заряд которых противоположен по знаку заряду коллоидных частиц, может наблюдаться не коагуляция, а стабилизации золя и перемена знака дзета-потенциала. Это явление получило в коллоидной химии название перезарядки золей. Так, при добавлении к золю платины небольших количеств хлорида железа FeCl3 наблюдается понижение отрицательного заряда коллоидных частиц платины и их коагуляция. Дальнейшее увеличение концентрации FeCl3 приводит к перезарядке коллоидных частиц платины; они получают положительный заряд.
Дата добавления: 2016-02-20; просмотров: 2252;
