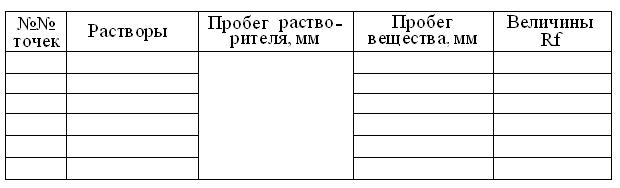
Хроматография аминокислот и пептидов на бумаге
Принципы метода: 1. Смесь двух частично смешивающихся жидкостей, одна из которых – вода, а другая – водонасыщенный органический растворитель, например фенол или н-бутанол, движутся по капиллярам бумаги с разными скоростями, т.к. полярная вода, связываясь с полярной же целлюлозой носителя, создает неподвижную фазу. Напротив, менее полярный органический растворитель движется по бумаге быстрей и служит подвижной фазой.
2. От обычной фильтровальной, хроматографическую бумагу отличает лишь большая (до 22 %) способность к связыванию воды.
3. В зависимости от направления движения смеси по носителю, различают одномерную радиальную, восходящую, нисходящую и двумерную хроматографию.
4. Соответственно структуре своих радикалов, α-аминокислоты и низкомолекулярные пептидылучше растворяются в той или иной фазе элюента и, как вариант распределительной хроматографии, тоже движутся по носителю с разными скоростями.
5. Экспериментально найдено, что деление аминокислот и пептидов идет эффективней в трехкомпонентных системах растворителей, так как добавки кислот, оснований, спиртов и др., с одной стороны, повышают гидрофильность подвижной фазы, а с другой – изменяют диссоциацию кислых и основных групп компонентов разделяемой смеси.
6. Выявление = индикацию всех компонентов смеси ведут, опрыскав высушенную хроматограмму из пульверизатора, раствором нингидрина, флуорескамина или о-фталевого диальдегида. Два последних индикатора, в присутствии восстановителей образуют с первичными аминами флуоресцирующие продукты, повышая чувствительность метода до 10-9 – 10-11 моля.
7. Выявленные пятна идентифицируютсравнением со «свидетелями» = чистыми образцами изучаемых веществ и, с помощью расчета коэффициентов подвижности: Rf = a/b, где а и b, соответственно, расстояния в миллиметрах, пройденные веществом и фронтом растворителя. Для данной системы растворителей, величина Rf каждого компонента – const.
Ход работы:
1. Избегая вероятного проявления отпечатков собственных пальцев, кожа которых секретирует много свободных аминокислот, взять за ребра бумажный диск или квадрат хроматографической бумаги, стороны которого немного больше диаметра чашки Петри и, поместить его на чистый лист своей лабораторной тетради.
2. С помощью линейки и тонко отточенного простого карандаша, без нажима, разделить диск на 4 – 6 примерно равных секторов.
3. Исходя из толщины круглых карандашей – 8 мм, его острием сделать в центре диска отверстие диаметром 6-8 мм.
4. Отступив от края отверстия на 5-10 мм, в каждом секторе поставить заметные точки старта, учитывая, что графит, препятствует растеканию водных растворов! Сбоку обозначить точки цифрами 1, 2, 3 и т.д., а на краю или в углу листа, указать № или инициалы владельца хроматограммы.
5. Положить диск на керамическую поверхность стола и, заполняя соответствующие графы таблицы протокола, нанести капиллярами на точки старта по капле 0,4 % растворов смеси аминокислот и «свидетелей» – аланина, лейцина, лизина, глутаминовой кислоты и дипептида.
6. Пока влажные пятна хроматограммы высыхают на воздухе, свернуть из полоски фильтровальной бумаги шириной 10-15 мм «ножку» или «фитиль» и вставить его в отверстие диска.
7. Открыть чашку Петри с ~10 мл смеси растворителей н-бутанол : уксусная кислота : вода в соотношении 4:1:5 и положить на ее края высушенный диск, проследив, чтоб ножка погрузилась в смесь растворителей.
8. Прикрыть систему крышкой чашки Петри, засечь время начала хроматографии и периодически контролировать движение фронта растворителя по бумаге.
9. Дождавшись подхода растворителя к краям бумаги, снять крышку чашки Петри и, пинцетом уложить на нее влажный диск, отметив в протоколе температуру помещения и время хроматографии.
10. Удалив ножку, высушить хроматограмму в сушильном шкафу при 90-100 С, в течение 10 мин.
11. Опрыскать хроматограмму 0,2 % раствором нингидрина в 96 % этаноле и повторно высушить ее в течение 5 мин.
12. Измерить в мм расстояние, пройденное фронтом растворителя от точки старта и занести его в таблицу протокола занятия.
13. Промаркировав карандашом середину каждого пятна хроматограммы, измерить расстояния их пробега от точек старта, занося результаты в таблицу протокола.
14. Рассчитать для каждого из пятен величину коэффициента распределения = Rf и занести результаты в таблицу протокола занятия.
15. Подтвердить результаты идентификации пятен смеси аминокислот, сравнив их положения со «свидетелями».
16. По мере возможности сделать выводы о влиянии температуры среды на скорость хроматографии и, взаимосвязи структуры аминокислот с их подвижностью в данной системе растворителей.
8.3.2. Гель-хроматография смеси на колонке Сефадекса G – 50
Принцип метода:Разделение смесей этим способом основано с одной стороны, на различиях в размерах их молекул, а с другой - на соизмеримости разделяемых молекул с размерами пор гранул гелей (рис. 8.2). Поэтому крупные макромолекулы в поры геля не проникают и элюируются с колонок первыми. Напротив, чем мельче размеры молекул других компонентов смеси, тем чаще они попадают через поры в гранулы и, задерживаясь в колонке, выходят из нее позже, то есть в больших объемах элюата. Отсюда синонимы метода: гель-фильтрация или метод молекулярных сит.
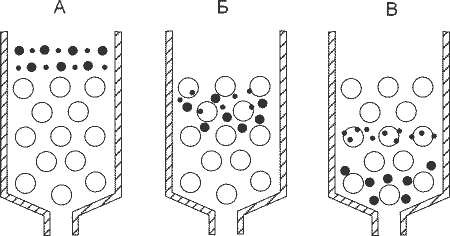
Рис. 8.2. Схема гель-фильтрации двухкомпонентной смеси
(по http://www2.usu.ru/biology/plant_phys/posob_bio_cont.htm)
Свойства молекулярных сит имеют многие пористые материалы, начиная с природных или искусственных цеолитов, полиакриламида и пористого стекла, несжимаемых при гидростатическом давлении. Напротив, трехмерные гели агарозы и декстрана (коммерческие названия Сефадекс – Pharmacia, Швеция; Молселект – Reanal, Венгрия), благодаря высокому содержанию гидроксильных групп легко набухают, но и сжимаются при избытке давления или скорости истечения элюата, что нежелательно, во избежание регенерации колонки! Как правило, большие марки препаратов, идущих за их названием, отражают большую степень набухаемости и более крупный размер гранул, при меньшей степени их поперечной сшитости, позволяющих разделять вещества в широком диапазоне молекулярных масс.
Ход работы:
1. На входе в колонку 0,9 x 15 см, заполненную гелем Сефадекса G – 50 (Pharmacia, Швеция) удалить пробку и, контролируя положение колонки в штативе с двух взаимно перпендикулярных позиций, довести его зажимами штатива до строго вертикального.
2. Убедившись, что поверхность геля строго горизонтальна и прикрыта фильтром, отрегулировать винтовым зажимом скорость истечения элюата в стакан-приемник до 10 – 15 капель/мин.
3. Дождавшись впитывания элюента на входе в колонку, не допуская подсыхания и взмучивания носителя, пипеткой по каплям, осторожно нанести на гель 0,5 мл смеси (1:1) 0,5 % раствора декстрана голубого (M = 2000 кДа) и насыщенного раствора рибофлавина (M = 376 Да).
4. Параллельно, заменить на выходе из колонки стакан-приемник, штативом с мерной центрифужной пробиркой № 1.
5. Как только делимая смесь впитается в гель, осторожно наслоить на него 5 мл физиологического раствора (0,85 % хлорид натрия) и повторять эту процедуру в течение всего опыта (30 – 40 мл).
6. Ориентируясь на изменения цвета элюата, продвигать под колонкой штатив, собирая тем самым в центрифужные пробирки №№ 1-4, его бесцветную, голубую, бесцветную и жёлтую фракции.
7. В соответствии с Инструкцией по эксплуатации фотоэлектроколориметра модели КФК-2. (п. 4.3.1. данного пособия), включить прогрев ФЭКа.
8. Убедившись, что колонка достигла исходного состояния, снова заменить штатив стаканом-приемником и, дополнительно промыть ее 10-15 мл физраствора.
9. Перекрыть зажимом выход колонки, оставив над поверхностью геля 1,5-2 мл элюента и закрыть вход в нее пробкой.
10. Определить объёмы полученных фракций элюата и занести результаты в таблицу протокола:
Результаты гель-фильтрации смеси на колонке 0,9 х 15 см
Сефадекса G-50
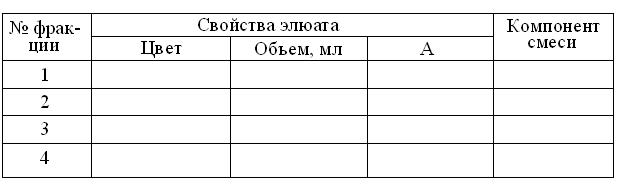
11. В соответствии с вышеупомянутой (п. 7) инструкцией, измерить против воды абсорбцию полученных фракций элюата при зеленом светофильтре (λ=540 нм) в кювете толщиной 5 мм, занося результаты в таблицу.
12. Построить график элюции с колонки, отложив по оси абсцисс объёмы элюата в мл, а по оси ординат – найденные величины А.
13. На основании данных эксперимента – идентифицировать компоненты исходной смеси.
СТАТИЧЕСКАЯ
Дата добавления: 2016-02-16; просмотров: 996;
