Перспективи розвитку сталеплавильного виробництва
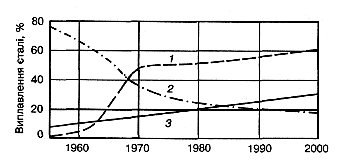
Розглянуті технологічні особливості виробництва сталі показують, що найбільші переваги серед них мають киснево-конвертерний і електроплавильний способи. Тому вони поступово витісняють мартенівський процес (рис. 1.14).
Слід також звернути увагу на те, що сучасні способи одержання сталі ґрунтуються на двостадійній переробці залізних руд: спочатку з них виплавляють чавун, а потім із чавуну одержують сталь. Такий спосіб складний, потребує великих витрат праці, часу, теплових і матеріальних ресурсів. При цьому потрібно враховувати і те, що сталеплавильне виробництво є одним із інтенсивних забруднювачів атмосфери. Металургійний завод продуктивністю 10 млн т сталі за рік без суворих заходів контролю викидає щорічно в атмосферу понад 200 тис. т пилу, 50 тис. т сполук сірки, 250 тис. т оксидів вуглецю, азоту та інших елементів. Останнім часом на багатьох металургійних комбінатах досягнуто високого рівня робіт, пов'язаних з охороною навколишнього природного середовища від забруднювальних викидів та практичною утилізацією і раціональним використанням усіх відходів виробництва.
 У ряді країн в промислових масштабах здійснено виробництво заліза безпосередньо з руди за різними технологічними схемами.
У ряді країн в промислових масштабах здійснено виробництво заліза безпосередньо з руди за різними технологічними схемами.
Рис. 1.14. Світове виробництво сталі:
1 - в кисневих конвертерах; 2 - в мартенівських печах; 3 - в електричних печах
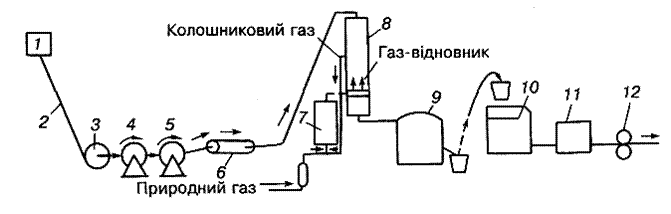 Рис. 1.15. Схема процесу бездоменного виробництва сталі
Рис. 1.15. Схема процесу бездоменного виробництва сталі
 Технологічну схему процесу бездоменного виробництва сталі показано на рис. 1.15. Сировиною для одержання заліза є концентрат з 70 % Fe, що подається трубопроводом 2 із збагачувального комбінату 1 у вигляді пульпи (суміші з водою). Після відстоювання пульпи осад концентрату зневоднюється за допомогою дискових вакуум-фільтрів 3, змішується в барабанних змішувачах 4 із зв'язкою (бентонітом) і піддається гранулюванню в установці 5. Одержані обкотки обпалюють у печі 6 і подають конвеєром у шахтну піч 8 прямого відновлення заліза. Знизу в піч подається газ-відновник з температурою 1000 °С під тиском 0,15 Па, який утворюється в рефор-мері 7 при взаємодії природного і колошникового газів: СН4 + СО2 -= 2СО + 2Н2. У результаті реакції відновлення масова частка заліза в об-котках підвищується до 95 %. Далі обкотки надходять в електропіч 9 місткістю 150 т, плавляться, метал очищається від домішок, до нього добавляють потрібні концентрати і дістають леговану сталь, яка розливається на МБЛЗ 10. Зливки підігрівають у печі 11 і прокатують на стані 12. Об'єм виплавленої цим методом сталі в світі поки що становить близько 2 %.
Технологічну схему процесу бездоменного виробництва сталі показано на рис. 1.15. Сировиною для одержання заліза є концентрат з 70 % Fe, що подається трубопроводом 2 із збагачувального комбінату 1 у вигляді пульпи (суміші з водою). Після відстоювання пульпи осад концентрату зневоднюється за допомогою дискових вакуум-фільтрів 3, змішується в барабанних змішувачах 4 із зв'язкою (бентонітом) і піддається гранулюванню в установці 5. Одержані обкотки обпалюють у печі 6 і подають конвеєром у шахтну піч 8 прямого відновлення заліза. Знизу в піч подається газ-відновник з температурою 1000 °С під тиском 0,15 Па, який утворюється в рефор-мері 7 при взаємодії природного і колошникового газів: СН4 + СО2 -= 2СО + 2Н2. У результаті реакції відновлення масова частка заліза в об-котках підвищується до 95 %. Далі обкотки надходять в електропіч 9 місткістю 150 т, плавляться, метал очищається від домішок, до нього добавляють потрібні концентрати і дістають леговану сталь, яка розливається на МБЛЗ 10. Зливки підігрівають у печі 11 і прокатують на стані 12. Об'єм виплавленої цим методом сталі в світі поки що становить близько 2 %.
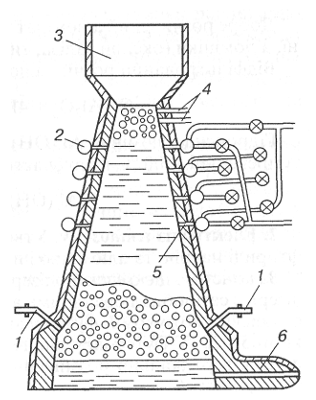
 Більш раціональним є одностадійний високотемпературний процес прямого відновлення рідкого заліза при температурі 1350...1650 °С. Цей процес здійснюється в протитечійній шахтній печі (рис. 1.16). Руда надходить у піч через завантажувальний пристрій 3. Крізь отвори 4 подається кисень, який забезпечує допалювання CO у верхній частині печі. Кільцевими трубами 2 крізь отвори 5 подається відновлювальний газ. Відновлене залізо плавиться пальниками 1 і зливається крізь випускні отвори (фурми) 6. Подальша переробка заліза в сталь може бути такою самою, як і при низькотемпературному процесі.
Більш раціональним є одностадійний високотемпературний процес прямого відновлення рідкого заліза при температурі 1350...1650 °С. Цей процес здійснюється в протитечійній шахтній печі (рис. 1.16). Руда надходить у піч через завантажувальний пристрій 3. Крізь отвори 4 подається кисень, який забезпечує допалювання CO у верхній частині печі. Кільцевими трубами 2 крізь отвори 5 подається відновлювальний газ. Відновлене залізо плавиться пальниками 1 і зливається крізь випускні отвори (фурми) 6. Подальша переробка заліза в сталь може бути такою самою, як і при низькотемпературному процесі.
Запитання і завдання для самоконтролю
1. У чому суть виплавки сталі?
2. Охарактеризуйте суть виплавки сталі в конвертері, мартенівській
та електричній печах. У чому перевага та недоліки цих способів,
перспективи їх розвитку?
3. Охарактеризуйте основні способи підвищення якості сталі
позапічною обробкою.
ГЛАВА 4. ВИРОБНИЦТВО КОЛЬОРОВИХ МЕТАЛІВ
16. Виробництво алюмінію
Алюміній - найпоширеніший метал у земній корі. Його масова частка 8,8 %. Алюмінієвими рудами є боксити, нефеліни, апатити, алуніти. Алюміній міститься в них у вигляді глинозему А12О3, його гідратів АІ2О3 • пН2О та інших сполук.
Основною промисловою сировиною для одержання алюмінію є бокси-ти До їхнього складу може входити до 60 % А12О3; 13 % SiO2; 23 % Fe2O3; 10 % ТіО2. Алюміній у них міститься у вигляді гідроксидів А12О3 • п Н2О
Виробництво алюмінію складається з двох процесів: виділення глинозему з руди і його електроліз.
1. Глиноземодержують з бокситів в основному лужним способом. Для цього подрібнений боксит піддають вилуговуванню в автоклавах при температурі 100...250 °С у концентрованому розчині лугу NaOH:
АI2О3 • п Н2О + 2NaOH = Na2O • АI2О3 + (n + 1) Н2О.
Добре розчинений алюмінат натрію Na2O • А12О3 залишається у розчині, а домішки (оксиди заліза, титану та ін.) випадають у осад. Відфільтрований розчин алюмінату натрію гідролізують:
Na2O • АI2O3 + 4Н2О = 2NaOH + 2АI (ОН)3.
Гідроксид алюмінію АI(ОН)3 випадає в осад. Його прожарюють при температурі 1200 °С в трубчастих обертових печах і дістають глинозем:
2АI (ОН)3 = АI2O3 + ЗН2O.
2. Електроліз глинозему.Утворений глинозем розчиняють у кріоліті -фториді натрію та алюмінію і піддають електролізу в електролізерах.
За конструкцією електролізери бувають різні. Найпоширеніші електро-лізери з самообпалювальними анодами (рис. 1.17). Ванна для електролізу є сталевим кожухом 1, футерованим шамотною цеглою 2 і вугляними блоками 3 і 12. У футеровку дна вмонтовані сталеві катодні шини 13. Анодами є вертикально розміщені вугляні електроди 9, занурені в розплав електроліту 4.
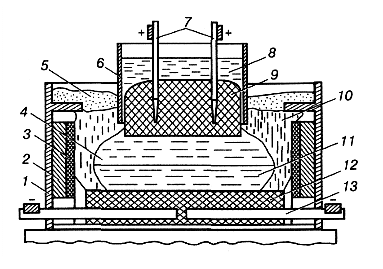
Рис. 1.17. Схема електролізера для добування алюмінію:
1 - сталевий кожух; 2 - шамотна футеровка; 3- вугляна футеровка;
4 - рідкий електроліт; 5 - глинозем;
6 - кожух анода; 7 - металеві стрижні;
8 - анодна маса; 9 - анод;
10- кірка затверділого електроліту;
11 - рідкий алюміній; 1
2 - катодні вугляні блоки;
13 - катодні шини
При проходженні струму напругою 4,0...4,5 В і силою 75...150 кА електроліт нагрівається до температури 930...950 °С. Частина електроліту утворює на боковій поверхні ванни захисний шар (гарнісаж), а на поверхні - кірку 10. На цю кірку періодично насипають чергову порцію глинозему 5.
Оскільки нижня частина анода 9 згоряє і він поступово опускається, потрібно нарощувати його верхню частину. Для цього в кожух 6 анода систематично завантажують анодну масу 8, яка плавиться за рахунок теплоти, що надходить з ванни, і потім коксується на поверхні анода, нарощуючи його.
Дисоціація кріоліту і глинозему проходить за такими реакціями:
АI2О3 = А13+ + AIO 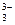
АIO 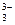 = АI3+ + 3О2-.
= АI3+ + 3О2-.
Катіон А13+ розряджається на катоді - дні ванни і утворює рідкий алюміній, а аніон О2- - на аноді. При цьому вуглець анода окислюється до CO і СО2. Рідкий алюміній раз в 1.. .2 доби зливають за допомогою сифона або вакуум-ковша. Продуктивність електролізера - близько 350 кг алюмінію на добу. Щоб добути 1 т алюмінію, треба витратити 15...17 тис. кВт-год електроенергії.
3. Рафінування алюмініюполягає в продуванні рідкого металу хлором протягом 10... 15 хв. Утворюваний при цьому пароподібний хлорид алюмінію А1С13 адсорбується на поверхні неметалевих домішок, які спливають у вигляді шлаку. Хлор також сприяє видаленню розчинених газів (О2, СО2).
Після рафінування і відстоювання протягом ЗО...45 хв алюміній досягає чистоти 99,85 %. При більш високих вимогах до алюмінію щодо чистоти, його піддають ще й електролітичному рафінуванню. Такий алюміній має чистоту до 99,99 %.
Первинний алюміній виготовляють особливої чистоти А999 (99,999 % А1); високої чистоти - А995 (99,995 % А1), А99 (99,99 % Al), A97 (99,97 % А1), А95 (99,95 % А1) і технічної чистоти - А85, А8, А7, А6, А5, АО (99,0 % А1).
17. Виробництво магнію
Масова частка магнію в земній корі 2,4 %. Рудами магнію є карналіт MgCl2 • КС1 • 6Н2О, магнезит MgCO3, доломіт MgCO3 • СаСО3, бішофіт MgCl2 • 6Н2О.
Найпоширенішим способом виробництва магнію є електролітичний. Він складається з двох процесів - добування хлориду магнію MgO2 і його електролізу.
1. Основною сировиноюдля виробництва магнію є карналіт. З метою збагачення карналіт обробляють гарячою водою. При цьому хлориди MgCl2 і КС1 переходять у розчин, з якого при охолодженні дістають кристали штучного карналіту.
Для видалення вологи штучний карналіт обпалюють в обертових або з "киплячим" шаром печах і плавлять в хлораторах, щоб зменшити вміст оксиду MgO в безводному карналіті. Магнезит і доломіт спочатку обпалюють, а потім піддають хлоруванню в присутності вуглецю і одержують хлорид магнію MgCl2.
2. Електроліз хлоридумагнію здійснюють у футерованих шамотом електролізерах, які складаються з ряду комірок з вугляним анодом 4 (рис. 1.18) і двома катодами у вигляді сталевих пластин 2. У верхній герметизованій частині комірки анодний простір відокремлений від катодного шамотною перегородкою 1 для збирання і відведення хлору.
Електролітом для добування магнію є розплав солей MgCl2, СаС12, NaCl, KC1 з добавкою NaF і KF. Електроліз ведуть при температурі 720 °С, електричній напрузі близько 3 В і силі електричного струму ЗО...50 кА. Витрата електроенергії для добування 1 т магнію становить 15...17кВт- год.
Іони магнію, що утворюються при електролізі, розряджаються на катодних пластинах 2, збираються в краплі й спливають на поверхню електроліту. Рідкий магній періодично видаляють вакуум-ковшом. Іони хлору розряджаються на аноді, виходять на поверхню під перегородкою 1 і відкачуються насосом. На дні ванни утворюється шлам 3.
 3. Рафінування магнію.Чорновий магній містить до 2...5 % різних домішок, тому в більшості випадків його піддають рафінуванню - переплавці з флюсами, до складу яких входять хлориди магнію, барію, калію, натрію
3. Рафінування магнію.Чорновий магній містить до 2...5 % різних домішок, тому в більшості випадків його піддають рафінуванню - переплавці з флюсами, до складу яких входять хлориди магнію, барію, калію, натрію
тощо. Переплавку здійснюють в електропечах при температурі 720 °С протягом 0,5... 1 год. Перемішування розплаву сприяє розчиненню домішок у флюсі, спливанню та переходу в шлак. Чистота рафінованого магнію досягає 99,9 %.
Рис. 1.18. Схема електролізера
для добування магнію:
1 - перегородка; 2 - сталеві катоди;
3 - шлам; 4 - графітовий анод
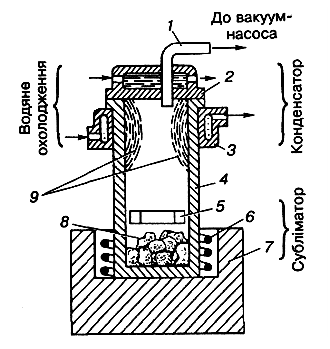 Більш глибоке очищення магнію можна здійснити його сублімацією у вакуумі.
Більш глибоке очищення магнію можна здійснити його сублімацією у вакуумі.
 Магній-сирець 8 (рис. 1.19) завантажують у сталеву реторту 4, яка герметично закривається кришкою 2. У верхній частині реторти встановлено кільцеву камеру 3. Кришка і кільцева камера охолоджуються текучою водою. Розрідження в порожнині реторти утворюється за допомогою вакуум-насоса, з'єднаного з ретортою трубкою 1. Нижня частина реторти є субліматором. її встановлено в нагрівнику, який становить собою спіраль-опору б, вміщену в теплоізоляції 7. Під час проходження електричного струму нижня частина реторти нагрівається до температури 600 °С. Внаслідок цього в умовах глибокого вакууму в нижній частині реторти утворюється пара з магнію, яка проникає по кільцевій щілині між стінкою реторти й екраном 5 у зону конденсації. Тут пара, стикаючись із більш холодними стінками реторти (з температурою 450...500 °С), осідає на них у вигляді кристалів магнію 9. Після рафінування магній переплавляють і розливають у зливки.
Магній-сирець 8 (рис. 1.19) завантажують у сталеву реторту 4, яка герметично закривається кришкою 2. У верхній частині реторти встановлено кільцеву камеру 3. Кришка і кільцева камера охолоджуються текучою водою. Розрідження в порожнині реторти утворюється за допомогою вакуум-насоса, з'єднаного з ретортою трубкою 1. Нижня частина реторти є субліматором. її встановлено в нагрівнику, який становить собою спіраль-опору б, вміщену в теплоізоляції 7. Під час проходження електричного струму нижня частина реторти нагрівається до температури 600 °С. Внаслідок цього в умовах глибокого вакууму в нижній частині реторти утворюється пара з магнію, яка проникає по кільцевій щілині між стінкою реторти й екраном 5 у зону конденсації. Тут пара, стикаючись із більш холодними стінками реторти (з температурою 450...500 °С), осідає на них у вигляді кристалів магнію 9. Після рафінування магній переплавляють і розливають у зливки.
Магній можна одержати також термічним способом - відновленням його оксиду MgO вуглецем, силіцієм або феросиліцієм при високих температурах та відносно глибокому вакуумі.
Виплавляється первинний магній таких марок: Мг96 (99,96 % Mg), Мг95 (99,95 % Mg) і Мг90 (99,90 % Mg).
Виробництво титану
За масовою часткою у земній корі (0,61 %) титану належить четверте місце після алюмінію, заліза та магнію. Відомо близько 60 мінералів титану, з них найбільш промислове значення мають ільменіт FeO • ТіО2, рутил ТіО2, сфен (титаніт) СаО • ТіО2 • SiO2.
Важливим джерелом ільменіту є титаномагнетитові залізні руди - суміші ільменіту з магнетитом Fe3O4 і частково з гепатитом Fe2O3. Після гравітаційного і магнітного збагачення цих руд дістають концентрат з масовою часткою до 40 % ТіО2, 50 % оксидів заліза та до 8... 10 % інших оксидів.
1. Добування титану.Відомо кілька способів добування титану. Частіше для цього застосовують вибірне відновлення за схемою, наведеною на рис. 1.20.
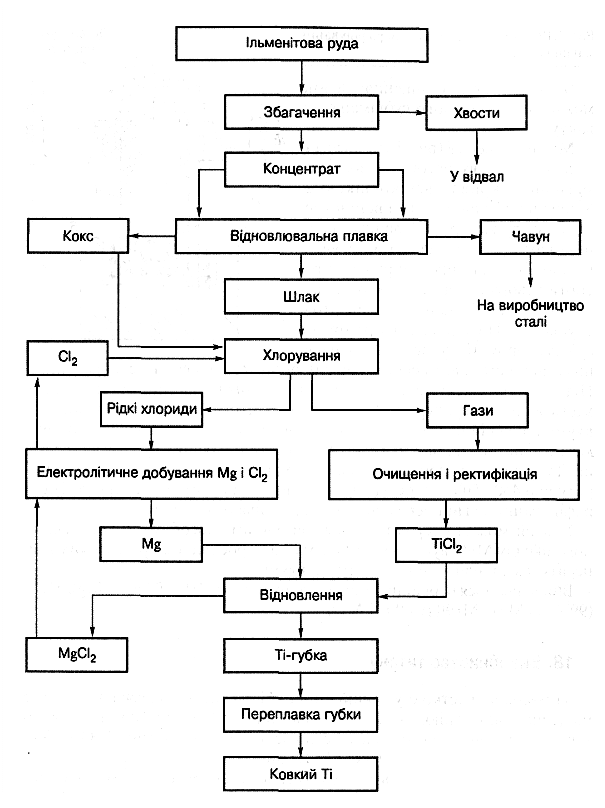
Рис. 1.20. Схема виробництва титану
За цією схемою концентрат шихтують з коксом, брикетують і переплавляють в електропечі. В результаті плавки відновлюються оксиди заліза і утворюється чавун з 2,5...3,0 % С та невеликою кількістю (0,4...0,9 %) Si і Мn. Оксиди титану та силіцію утворюють шлак з масовою часткою 65...85 % ТіО2, 10... 15 % SiO2 та інших оксидів. Цей шлак піддають хлору-
ванню - обробці в хлораторі розплавленими хлоридами MgCl2, KaCl, NaCl. Хлор надходить у хлоратор через ряд фурм.
У присутності коксу ТіО2 хлорується при температурі близько 600 °С за реакцією ТІO2 + 2С12 + С = ТІС14 + СO2.
Разом с хлоридом титану утворюються і хлориди деяких домішок (SіС12, FeCl3, MgCl2 та ін.).
Хлорид ТіС14 плавиться при температурі мінус 23 °С і кипить при 136 °С. Тому він виділяється в хлораторі у вигляді пари, яка вбирає в себе леткі хлориди силіцію та заліза. Менш леткі хлориди магнію, кальцію та інших металів утворюють рідину.
Парогазову суміш із хлоратора спрямовують у складну систему конденсаційних установок, в яких вона ступінчасте охолоджується і завдяки різній температурі конденсації домішок хлоридів і титану очищається. Після конденсації ТіС14 відстоюють від твердої фази і піддають складному тривалому очищенню методом ректифікації. Металевий титан дістають відновленням ТіС14 магнієм у циліндричних сталевих герметичних ретортах діаметром 0,9...1,5 м і заввишки 1,8...3,0 м. Реторту вставляють вертикально в електропіч опору. Зверху реторта закривається кришкою з патрубками для подавання магнію, хлориду ТіС14, відкачування і підведення аргону.
Після відкачування повітря реторту заповнюють аргоном, нагрівають до температури 750...800 °С, заливають рідкий магній і починають подавати рідкий хлорид титану. Відновлення відбувається за реакцією
ТІС14 + 2Mg = 2MgCl2 + Ті.
Титан в реторті виділяється у вигляді губки, а рідкий хлорид магнію періодично виливають крізь патрубок в дні реторти. Після завершення реакції включають нагрівання і витримують реторту ще 1 год при температурі 1000...1100 °С. Після цього реторту виймають із печі й охолоджують до температури 20...40 °С. Весь процес відновлення в заводських умовах триває 30...35 год. За одну операцію добувають до 1,5 т титану.
Титанова губка містить до 35...45 % магнію і хлориду магнію, а також деякі інші домішки. Тому її очищають методом вакуумної дистиляції - видержуванням протягом 25...40 год у вакуумі з залишковим тиском близько 0,1 Па при температурі 900 °С. При цьому частина домішок виводиться у вигляді розплаву, інші випаровуються, а потім конденсуються.
Титанову губку плавлять у вакуумних електродугових печах з мідним тиглем, який охолоджується водою. Одним із електродів є стрижень з пресованої титанової губки, другим - розплавлений метал. Під час -
горіння дуги стрижень оплавляється, краплі титану стікають І затверді-вають у зливок. Вакуум захищає метал від окислювання і сприяє його очищенню від розчинених газів. Проте одержані зливки ще містять деякі домішки і мають різні дефекти. Тому застосовують повторну переплавку, в якій зливки є електродами. Вторинні зливки мають значно більшу чистоту.
У рідкому стані титан енергійно взаємодіє майже зі всіма вогнетривкими матеріалами, з яких виготовляють тиглі. Тому титанові відходи переплавляють вакуумно-дуговою гарнісажною плавкою в графітовому тиглі, внутрішня поверхня якого облицьована шаром твердого титану завтовшки 2...З мм (гарнісажем). У тигель завантажують титанові відходи і титанову губку. Плавку ведуть у вакуумі за допомогою дуги між титановим електродом і шихтою. Гарнісажні печі дають змогу одержати до 5... 10 т рідкого металу за плавку.
Чистота титану, утвореного переплавкою губки, становить 99,6... 99,7 %. Титан з меншим вмістом домішок добувають термічним розкладанням його летких сполук. Особливо легко розкладаються сполуки металів з йодом. Такий спосіб очищення називають йодидним.
Йодидне очищення титану здійснюється в реакторі - молібденовому циліндрі з необхідними пристроями. Забруднений титан (губку) завантажують у реактор і нагрівають до температури 550 °С. Потім реактор знегажують відкачуванням вакууму, охолоджують до температури 200 °С і вводять йод. Утворюється сполука - тетрайодид титану ТіІ4 з температурою плавлення 156 °С.
Термічна дисоціація відбувається за рівнянням:
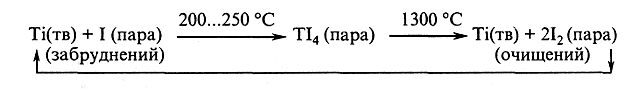
Утворювані пари йодиду ТіІ4 попадають на поверхню розміщеного в реакторі тонкого титанового дроту завдовжки близько 2,5 м, нагрітого пропусканням електричного струму напругою 40 В і силою близько 60 А до температури 1300 °С, і розпадаються з виділенням атомів титану (чистого) і утворенням прутка діаметром у кінці процесу 25...30 мм. При цьому атоми йоду звільняються і знову реагують з титаном.
Особливістю йодидного способу очищення є те, що найбільш шкідливі домішки (С, О2, N2) не транспортуються йодом від забрудненого металу до чистого на розжареному дроті, тому цей спосіб забезпечує одержання високопластичного металу. Цей спосіб застосовують також для очищення хрому, ванадію, цирконію, торію та інших металів.
Губчастий титан виплавляють марок ТГ90, ТГ100...ТГ150, де число визначає твердість губки за Брінеллем. Технічний титан, одержаний переплавкою губки і відходів: ВТ1-00 (99,53 % Ті), ВТ1-0 (99,46 % Ті).
19. Виробництво міді
Масова частка міді в земній корі 0,01 %. Мідні руди містять 1...5% міді. Мідь у них міститься у вигляді сірчистих сполук CuS, Cu2S або CuFeS2, оксидів СuO і Сu2О, карбонатів. Поряд з міддю ці руди часто містять нікель, цинк, свинець, золото, срібло та інші метали.
Добувають мідь з сульфідних руд пірометалургійним способом. У процес виплавлення міді входять: збагачення і випалення руди, виплавлення напівпродукту - штейну, з якого потім одержують чорнову мідь. Для очищення від домішок чорнову мідь рафінують.
1. Збагачують мідні руди методом флотації, заснованим на різному змочуванні водою сполук міді й пустої породи. У флотаційній машині подрібнена руда, вода і флотаційні реагенти (наприклад, смерекова олія) утворюють пульпу. Флотаційні реагенти адсорбуються на частинках руди у вигляді погано змочуваної водою плівки. При продуванні пульпи бульбашки повітря концентруються на поверхні цих частинок і піднімають їх наверх, утворюючи шар піни, а змочувана водою пуста порода осідає на дно ванни. Після фільтрації і сушіння зібраної піни утворюється концентрат з масовою часткою міді 15...35 %.
 2. Випалюють концентрат при температурі 750...850 °С в повітряній атмосфері з метою окислення сульфідів і зменшення вмісту сірки. Прогресивним є випалювання у "киплячому" шарі. Концентрат завантажують у піч крізь вікно 3 (рис. 1.21). Знизу в піч каналом 2 крізь отвори в піддоні 1 надходить повітря. Тиск повітря встановлюється таким, щоб частинки концентрату були в завислому ("киплячому") стані. Випалений концентрат "переливається" через поріг печі 5 у вигляді недогарка. Сірчисті гази, що відходять, очищають у циклонах 4 і направляють в сірчанокислотне виробництво.
2. Випалюють концентрат при температурі 750...850 °С в повітряній атмосфері з метою окислення сульфідів і зменшення вмісту сірки. Прогресивним є випалювання у "киплячому" шарі. Концентрат завантажують у піч крізь вікно 3 (рис. 1.21). Знизу в піч каналом 2 крізь отвори в піддоні 1 надходить повітря. Тиск повітря встановлюється таким, щоб частинки концентрату були в завислому ("киплячому") стані. Випалений концентрат "переливається" через поріг печі 5 у вигляді недогарка. Сірчисті гази, що відходять, очищають у циклонах 4 і направляють в сірчанокислотне виробництво.
3. Штейн виплавляють із концентрату в полуменевих відбивних печах (рис. 1.22). Такі печі будують завдовжки 40 м і місткістю шахти 100 т і більше. Опалюють піч мазутом, пилом вугілля або газом. Максимальна температура в головній частині печі 1550 °С поступово зменшується до хвостової частини до 1250... 1300 °С. Шихту 5 завантажують на під 4 вагонеткою 1 крізь отвори в склепінні 2. Під час плавки сульфід міді Cu2S реагує з оксидом Си2О і утворюється мідь:
 Cu2S + 2Cu2O = 6Cu + SO2.
Cu2S + 2Cu2O = 6Cu + SO2.


Мідь, що утворилась, і оксиди, які залишилися, реагують з сульфідом заліза:
2Cu + FeS = Cu2S + Fe;
Cu2O + FeS = Cu2S + Fe.
У результаті цих реакцій на поді печі скупчується і по льотці 3 стікає у ківш розплавлений мідний штейн - сплав сульфідів Cu2S, FeS, сульфідів металів-домішок та оксиду Fe3O4 з масовою часткою 20...45 % Сu, 20...40 % Fe, до 25 % S та домішки Аu, Ag, Zn, Ni тощо. Одночасно в печі утворюється шлак, в якому збираються оксиди, розчинені в розплавленому силікаті заліза.
Останнім часом для плавлення концентратів застосовують електричні печі і плавлення в киплячому стані, що дає змогу підвищити продуктивність процесу майже втричі порівняно з полуменевою відбивною піччю і зменшити енергозатрати на 30 %.
4. Чорнова мідь утворюється при продуванні розплавленого штейну повітрям у конвертері (рис. 1.23) - горизонтально розташованій посудині з листової сталі завдовжки 5... 10 м і діаметром 3...4 м, футерованій магнезитовою цеглою. Повітряне дуття підводиться трубами 3 і подається всередину конвертера 2 крізь 40...50 фурм 4, розміщених по його твірній. Для заливання штейну в горловину 1 і виливання продуктів плавлення конвертер повертають на роликах 5.
Конвертування проходить за два періоди. У першому періоді (5. ..25 год) окислюються сульфіди заліза і міді:
2FeS + ЗО2 = 2FeO + 2SO2;
2Cu2S + ЗО2 = 2Cu2O + 2SO2.
Оксид заліза FeO зв'язується флюсом - кремнеземом SiO2 і виділяється в шлак 2FeO - SiO2.
У другому періоді (2...З год) окислюються сульфіди міді й відновлюється мідь:
2Cu2S + ЗО2 = 2Cu2O + 2SO2;
Cu2S + 2Cu2O = 6Cu + SO2.
 Виплавлену мідь називають чорновою тому, що вона містить до 1,5 % домішок. Для очищення домішок чорнову мідь піддають вогневому і електричному рафінуванню.
Виплавлену мідь називають чорновою тому, що вона містить до 1,5 % домішок. Для очищення домішок чорнову мідь піддають вогневому і електричному рафінуванню.
5. Вогневе рафінуванняполягає в окисленні домішок у відбивних печах при продуванні чорнової міді повітрям. При цьому кисень повітря сполучається з міддю і утворює оксид Си2О, який потім реагує з домішками металів (Me) за реакцією
Cu2O + Me = 2Cu + MeO.
Одночасно окислюється і сірка:
 Cu2S + 2Cu2O = 6Cu + SO2.
Cu2S + 2Cu2O = 6Cu + SO2.
Після цього мідь розкислюють - відновлюють Сu2О, перемішуючи природним газом СН4. Вуглеводи сприяють видаленню газів і відновленню міді: 4Сu2О + СН4 = 8Сu + 2Н2О + СО2.
Після вогневого рафінування чистота міді досягає 99,7 %. Із неї відливають чушки для одержання сплавів або плити для електролітичного рафінування.
6. Електролітичне рафінуваннязастосовують для одержання міді чистотою 99,95 %. Електроліз проводять у спеціальних ваннах.
Анодами є пластини з чорнової міді розміром 1 × 1 м завтовшки 50 мм, катодами - листи завтовшки 0,5 мм з чистої міді, електролітом - водяний розчин сірчаної кислоти і сірчанокислої міді.
При проходженні струму напругою 2...3 В і густиною 100...400 А/м2 анод розчиняється, мідь переходить у розчин у вигляді катіонів, які потім розряджаються на катодах і відкладаються шаром чистої міді. При цьому домішки осідають на дно ванни у вигляді шламу. Іноді в шламі міститься до 35 % Ag, 6 % Se, 3 % Fe, 1 % Au та інші цінні елементи. Тому шлами переробляють з метою вилучення цих елементів.
Первинну мідь поставляють таких марок: МОО (99,99 % Сu), МО (99,95 % Сu), МІ (99,9 % Сu), М2 (99,7 % Сu), МЗ (99,5 % Сu).
20. Виробництво нікелю
Масова частка нікелю в земній корі становить 0,008 %. У природі він трапляється у вигляді сульфідних мідно-нікелевих і окислених (силікатних) руд з масовою часткою 0,3...2,0 % Ni.
Сульфідні мідно-нікелеві руди - цінна поліметалева сировина. Поряд з нікелем вони містять також мідь (переважно у вигляді халькопіриту CuFeS2), Co, Au, Ag, Pt. Із цих руд добувають понад 90 % Pt від загального її видобутку.
В окислених нікелевих рудах цінним супутником є кобальт, а іноді в значних кількостях залізо.
Виробництво нікелю із руд - складний багатостадійний процес і має багато спільного з виробництвом міді. Спочатку руду збагачують методом флотації з виділенням мідного і нікелевого концентратів (4...5 % Ni). Нікелевий концентрат звичайно частково випалюють, потім окусковують методом агломерації або обкатування. Після цього концентрат в суміші з флюсами плавлять в електричних або відбивних печах, щоб видалити пусту породу і перевести нікель у сульфідний розплав (штейн) з масовою часткою 10...15 % Ni. Поряд з нікелем у штейн переходить частина заліза, кобальт і майже повністю мідь і благородні метали.
Рідкий штейн продувають у конвертері - окислюють залізо і одержують файнштейн (сплав сульфідів і міді), який після охолодження подрібнюють і направляють на флотацію для розділення цих сульфідів. Нікелевий концентрат обпалюють у "киплячому" шарі до практично повного видалення сірки і одержання оксиду NiO.
Чорновий нікель дістають відновленням його оксиду в дугових електропечах і розливають у плити масою до 300 кг і розміром 800 х 900 мм -аноди для електролізного очищення. Катодами є листи із корозостійкої сталі або титану. Чистота електролітичного нікелю становить 99,99 %.
Для виділення міді й одержання нікелю високої чистоти використовують також карбонільний процес, заснований на зворотності реакції:
Ni + 4CO = Ni(CO)4.
Карбоніл нікелю Ni(CO)4 утворюється при тиску 1 ...20 МПа і температурі 200...250 °С, а його розкладання - при атмосферному тиску і температурі 200 °С. Карбонільний нікель виділяється у вигляді порошку високої чистоти.
Із окислених руд нікель добувають за дещо відмінною технологією або різними гідрометалургійними способами - аміачним вилуговуванням відновленої руди, сірчанокислотним автоклавним вилуговуванням тощо.
Нікель виплавляють таких промислових марок: НО (99,99 % Ni), НІ (99,93% Ni ), Н2 (99,8 % Ni), НЗ (98,6 % Ni), H4 (97,6 % Ni).
21. Виробництво тугоплавких металів
До тугоплавких належать метали, які мають температуру плавлення вищу, ніж у заліза, тобто 1539 °С. Проте, виходячи з певного комплексу характеристик, до цієї групи металів включають Сr (1870 °С), V (1900 °С), Nb (2500 °С), Mo (2620 °С), Та (2996 °С), W (3410 °С).
Оскільки Сr і V мають найменшу температуру плавлення, а Сr до того ж крихкий при температурі до 350 °С, найбільшу цінність як конструкційні матеріали має так звана "велика четвірка" тугоплавких металів: W, Мо, Nb і Та.
Тугоплавкі метали довгий час вважали непридатними для використання як конструкційні матеріали через їхню крихкість. Тепер відомо, що їхня пластичність значною мірою залежить від наявності домішок, в основному вуглецю та газів (О2, Н2, N2). Використання їх як конструкційних матеріалів стало можливим після розробки способів очищення металів до винятково малої масової частки домішок (10-4 …10-6 %).
Тугоплавкі метали одержують відновленням їхніх сполук активними металами, вуглецем або воднем, а також електролізом.
Хромміститься в земній корі в кількості до 3 • 10-2 % у вигляді кисневих сполук. Основною його рудою є хромистий залізняк FeCr2O4 з масовою часткою 42...55 % Сr2О3.
Залежно від призначення хром дістають у вигляді чистого металу або сплаву з залізом - ферохрому (60...85 % Сr). Ферохром виготовляють прямим відновленням хромової руди вуглецем (коксом) або силіцієм в електродугових печах.
Металевий хром одержують відновленням оксиду Сг2О3 алюмінієм чи силіцієм, або електролітичним відновленням розчинів його сполук.
Одним із способів одержання досить чистого хрому є електролітичне осадження із водяних розчинів хромово-амонієвих галунів або хромової кислоти. Однак такий хром містить значну кількість домішок кисню і водню. Водень можна видалити нагріванням у вакуумі, а кисень - високотемпературною обробкою воднем. Найчистіший хром дістають електролітичним рафінуванням, а також йодидним очищенням.
Ванадійдосить поширений у земній корі елемент (1,5 • 10-3 %). Відомо понад 65 мінералів, що містять у собі ванадій. Промислове значення мають титаномагнетитові залізні руди (містять до 1 % V) і осадові залізні руди (містять до 0,1 % V). Під час плавки таких руд у домні ванадій переходить у шлак з масовою часткою 10...15 % V2O5. Шлак обпалюють разом з NaCl при температурі 800...850 °С, вилужують обпалений матеріал водою і розводять сірчаною кислотою. Виділений із розчину і переплавлений технічний оксид ванадію містить близько 95 % V2O5, 3 % Na2O, 1 % Fe та інші домішки. Його використовують для виплавки ферованадію (сплав заліза з 35...70% V) і одержання чистого оксиду V2O5 для виробництва металевого ванадію. Такий ванадій дістають кальцієтермічним відновленням V2O5 або магнієтермічним відновленням хлориду VC13 (одержують хлоруванням ферованадію). Найчистіший ванадій дістають йодидним методом.
Ніобійміститься в земній корі в кількості 2 • 10~3 %. У численних мінералах він майже завжди є разом з танталом. Чистих ніобієвотанталових мінералів налічується
до 80.
Основними видами сировини для виробництва ніобію є лопарит з масовою часткою 8...10% (Nb,Ta)2O5, пірохрол - 37...65% Nb2O5 і до 10 % Та2О5; колумбіт-танталіт - 82...86 % (Nb2O5 + Ta2O5). Домішками в них можуть бути Si, Ті, Sn, Th, Fe, Ca та ін.
Руди ніобію бідні, оксиду в них звичайно 0,05...0,50 %, рідше 2 %. Тому їх обов'язково збагачують різними методами: гравітаційним з наступною флотацією, електромагнітною сепарацією тощо. Масова частка Nb2O5 у концентраті становить 30...60%. Більшу частину концентратів переробляють алюміно- або силіцієтермічним відновленням на фероніобій (40...60 % Nb ) і феротанталоніобій (до 50 % Nb + Та).
Оскільки ніобій і тантал мають досить близькі хімічні та фізичні властивості, виробляти чистий ніобій дуже важко.
У результаті досить складної хімічної і термічної обробки концентрату виділяють чисті сполуки: оксид Nb2O5 і фторніобат калію K2NbF7.
Із оксиду ніобій дістають звичайно в дві стадії. Спочатку із суміші Nb2O5 і сажі в атмосфері водню при температурі 1800 °С одержують карбід ніобію, потім із суміші карбіду і оксиду при 1800... 1900 °С у вакуумі - порошок ніобію.
Фторніобат калію відновлюють натрієм при температурі 1000 °С і дістають ніобій також у вигляді порошку. Здобутий порошок переробляють у компактний метал методом порошкової металургії: спресовують у шта-бики, спікають у вакуумі при температурі 2300 °С і проковують у холодному стані. З отриманих заготовок виготовляють прутки, дріт, пластини, стрічку тощо. Для одержання великих заготовок спечені штабики переплавляють у вакуумній дуговій печі.
Ніобій високої чистоти дістають електронно-променевим вакуумним плавленням, електролітичним і йодидним рафінуванням.
Тантал. Масова частка танталу в земній корі 2 • 10-4 %, тобто в 10 разів менша, ніж ніобію. Руди танталу рідкісні, звичайно комплексні й бідні. У промисловості використовуються навіть руди, які містять танталу до сотих часток процента.
Виробництво танталу мало чим відрізняється від виробництва ніобію. Після обробки концентрату одержують фтортанталат калію K2TaF7 і пентаоксид Та2О5, які відновлюють, як і ніобій, відповідно натріє- або карботермічним методом з незначними відмінностями і переробляють порошковою металургією в ковкий метал.
Молібден міститься в земній корі в кількості 3 • ІО-4 %. Відомо близько 20 мінералів молібдену. Найважливіші з них такі: молібденіт MoS2, повеліт СаМоО4, молібдит Fe2(MoO4) • nН2О і вульфеніт РвМоО4.
Основною сировиною для виробництва молібдену і його сплавів є стандартні молібденові концентрати з масовою часткою до 50 % Мо, 32 % Si, 5 % SiO2 і домішок Fe, Cu, Ca та інших елементів.
Концентрати піддають окислювальному випалюванню при 550...600 °С звичайно в печах з киплячим шаром. Продукт випалювання - недогарок
є оксидом МоО3, забрудненим домішками. Чистий оксид МоО3, потрібний для виробництва металевого молібдену, одержують сублімацією при 950...1000 °С, або хімічним методом - вилуджування молібдену аміачною водою з утворенням молібдату амонію, прожарювання якого при температурі 450...550 °С дає чистий оксид МоО3 з вмістом не більш як 0,05 % домішок.
Металевий молібден дістають у вигляді порошку відновленням оксиду МоО3 у потоці сухого водню в трубчастих печах за два етапи: при 550...600 °С і 950...1000 °С. Потім методом порошкової металургії одержують заготовки- штабики перерізом 20...80 мм2 і завдовжки 450...600 мм.
Для одержання крупних заготовок масою до 2 т застосовують плавку в печах з охолоджуваним мідним тиглем і електродом із спечених штабиків.
Феромолібден (до 50...70% Мо) дістають відновленням обпаленого концентрату (недогарка) феросиліцієм у присутності оксиду заліза Fe3O4.
Вольфраммало поширений у природі; його масова частка в земній корі становить 1 • 10-4 %.
Основною сировиною для виробництва вольфраму є вольфраміт (Fe, Mn)WO4 і шеєліт CaWO4 з масовою часткою WO3 лише до 2 %, тому їх збагачують різними способами, щоб одержати концентрати, які містять 50...60%WO3.
Переробляють концентрати в компактний метал за три етапи: а)хімічне виділення чистої вольфрамової кислоти H2WO4 або її солей; б) відновлення оксиду WO3 до металевого порошку; в) перетворення порошку в компактний метал.
Через високу температуру плавлення компактний вольфрам виробляють в основному методом порошкової металургії. Порошок пресують у штабики під тиском 200...300 МПа, спікають при температурі до 1300 °С у водні, а потім зварюють при температурі близько 3000 °С, пропускаючи крізь них електричний струм. Одержані штабики нагрівають до 1300...1600 °С у печі з водневою атмосферою і проковують. Із отриманих таким способом заготовок обробкою тиском виготовляють прутки, дріт, пластини, стрічки тощо.
Значні труднощі виникають під час виробництва листів із вольфраму, як і молібдену, оскільки при високій температурі вони інтенсивно окислюються і забруднюються. Щоб цього уникнути, обладнання для прокатування розміщують у спеціальних камерах і навіть цехах, наповнених інертним газом. У таких цехах робітники працюють у спеціальних скафандрах.
Запитання і завдання для самоконтролю
1. У чому суть процесів виробництва кольорових металів?
2. Наведіть характеристику основних способів рафінування
кольорових металів.
3. Наведіть особливості виробництва тугоплавких металів.
Глава 5. ОСНОВИ ПОРОШКОВОЇ МЕТАЛУРГІЇ
22. Загальні відомості
Порошкова металургія - це галузь, що охоплює виробництво порошків металів, їхніх сплавів і сполук, а також неметалевих матеріалів (графіту, сажі) і одержання з них напівфабрикатів, заготовок або готових виробів. При цьому основний компонент таких матеріалів не доводять до плавлення.
Сьогодні світове виробництво порошків металів (Fe, Cu, Ni, Co, Cr, W, Mo, V та ін.) і їхніх сплавів, а також сполук (карбідів, боридів, силіцидів тощо) з частинками розміром від ОД... 1,0 мкм до 1 мм перевищує 1 млн т за рік, а виробів з них - 550...600 тис. т. Щорічний приріст порошкової металургії становить в середньому 6...S %, а іноді 15...20 %.
Метод порошкової металургії цінний насамперед тим, що дає змогу діставати матеріали, які іншими методами дістати неможливо, наприклад, з металів із значною різницею температури плавлення (W + Cu; W + Ag та ін.), з металів і неметалів (бронза + графіт), з хімічних сполук (оксидів, карбідів, нітридів), з матеріалів з певною пористістю (підшипники ковзання, фільтри), з особливими електричними, магнітними та іншими властивостями.
Особливе місце серед порошкових матеріалів належить твердим сплавам, їх дістають із порошків карбідів WC, ТіС, ТаС з додаванням порошку кобальту. Вони мають велику твердість (85...92 HRA) і теплостійкість (900...1000 °С). Застосовують їх переважно для оснащення різального інструменту, який працює при значних навантаженнях і швидкостях різання.
Порошкова металургія відзначається також мінімальними втратами (іноді до 10 разів) матеріалів для виготовлення виробів, дає змогу значно зменшити верстатний парк та кількість робітників. Тому цей метод є високоефективним також при виготовленні деталей загального машинобудування або побутового призначення, які дістають литтям та обробкою різанням. Такі вироби виготовляють з порошків сталі, бронз, латуней та інших матеріалів, їх, як і литво, можна додатково обробляти різанням, піддавати термічній обробці.
Технологічний процес порошкової металургії включає (рис. 1.24) одержання порошків, підготовку шихти, пресування (формування) і спікання, а в деяких випадках і додаткову обробку - гаряче допресування, калібрування, просочування мастилами тощо.
23. Добування порошків
Для виготовлення спечених виробів використовують порошки розміром 0,5...500 мкм. Дістають такі порошки механічними та хімічними методами.
1. Механічні методи- це розмел стружки та відходів металообробки, розпилення рідкого металу.
Розмел здійснюють у вихрових і кульових млинах.

Рис. 1.24. Узагальнена технологічна схема виробництва
сталевих порошкових напівфабрикатів і виробів




Вихровий млин (рис. 1.25) складається з футерованого зносостійкою сталлю кожуха, всередині якого обертаються з частотою близько 300 об/хв два пропелери 1, що створює в робочій камері 2 вихрові потоки. Кусочки подрібнюваного металу у вигляді січки або дрібної стружки із бункера 5 надходять у камеру 2, підхоплюються цими потоками і, стикаючись між собою, подрібнюються на частинки порошку розміром 50...200мкм.
Під час розмелу частинки металу інтенсивно нагріваються. Для запобігання окисленню і самозайманню порошку кожух млина має водоохолоджувану оболонку, а в камеру нагнітається інертний або захисний газ. Він підхоплює частинки порошку і переносить у приймальну камеру 4, де крупні частинки відділяються і направляються в осаджувальну камеру 3 і далі на додатковий розмел, а дрібні - в контейнер.
У вихрових млинах подрібнюють в'язкі та крихкі метали (залізо, мідь, алюміній, вуглецеві й леговані сталі).
Кульовий млин має вигляд сталевого або футерованого твердими сплавами барабана, в якому міститься матеріал, розмелюваний важкими сталевими або твердосплавними кулями. Під час обертання бара-
- бана кулі підіймаються вгору, а потім, падаючи на розмелюваний матеріал, подрібнюють його. Частота обертання барабана залежить від його діаметра (звичайно 100...1500 мм) і становить 30...120 об/хв.
У кульових млинах подрібнюють крихкі, непластичні матеріали (силіцій, манган, хром, різні тугоплавкі сполуки). Берилій і манган розмелюють в азоті або аргоні, оскільки при значному подрібненні підвищується окислюваність і пірофорність їх.
У кульових млинах можна отримати найдрібніші частинки порошків розміром у кілька мікрометрів.
Спосіб одержання порошків розпиленням струменю рідкого металу (рис. 1.26) застосовують в основному для легкоплавких металів (олово, свинець, цинк, алюміній), заліза, нікелю та деяких інших металів, які мають температуру плавлення до 1500 °С. Цей спосіб простий і водночас високопродуктивний. Недоліком його є можливість окислення порошку. Щоб запобігти цьому, застосовують відновні або інертні гази під тиском 50...100МПа.
2. Хімічні методи полягають у відновленні металів з оксидів або солі вуглецем, воднем, природним газом. Відновленням дістають порошки заліза (з окалини), вольфраму, молібдену, хрому, міді та інших металів. До цих методів належить також термічна дисоціація карбонілів - сполук типу МеХ.(СО)У, (де Me - один з металів), яка дає змогу дістати порошки високої чистоти. Цим методом дістають порошки заліза, нікелю, кобальту та деяких інших металів для виготовлення в основному деталей для електро- та радіотехнічних пристроїв.
24. Підготовка порошків до формування
Для виготовлення якісних заготовок або деталей порошки відпалюють, розділяють за розмірами частинок, змішують.
Відпал порошку сприяє повному відновленню оксидів, видаленню вуглецю та домішок, а також усуненню наклепу. Все це стабілізує його властивості та поліпшує пресування. Відпалюють частіше порошки, добуті механічним подрібнюванням.
Порошки за розміром понад 50 мкм розділяють за допомогою набору сит, а дрібніші - повітряною сепарацією.
Властивості порошкових виробів значною мірою залежать від якості змішування компонентів шихти. Ця операція здійснюється в спеціальних змішувачах, кульових або вібраційних млинах та іншими способами.
Іноді в порошкову масу добавляють різні технологічні наповнювачі (наприклад, розчин каучуку в бензині) для поліпшення пресування і можливості виготовлення заготовок видавлюванням (екструзією) або для забезпечення можливості механічної обробки (парафін, віск), виготовлення заготовок литтям (спирт, бензол та ін.).
Дата добавления: 2016-02-09; просмотров: 3144;
