Структура белковой молекулы
Белки. Физико-химические свойства.
Функции белков в организме.
Строение белковой молекулы
Белки – это органические высокомолекулярные азотистые соединения, построенные из аминокислот.
Белки являются самыми важными составными частями всех живых организмов. На долю белков приходится 45% сухого вещества организма. Высокое содержание белков в селезенке 84%, легких 82%, мышцах 80%, почках 70% и т.д.
Химический состав белков: углерод 55%,
кислород 24%,
водород 7%,
азот 16%,
Сера 2,5%.
В отдельных белках содержатся: фосфор, железо, медь, цинк, марганец, магний, йод. Во всех белковых молекулах содержание азота довольно постоянно ~ 16%. Это лежит в основе определения концентрации белка в тканях.
Основные физико-химические свойства белков:
1.значительная (высокая) молекулярная масса – 6000 до 1000000 D;
2.высокая вязкость и возможность набухания в растворах;
3.неспособность диффундировать через полупроницаемые мембраны;
4.способность создавать высокое онкотическое давление;
Онкотическое давление в крови обусловлено присутствием белков и равно 0,02 – 0,04 атм., т. е. 30 мм рт. ст.
5.амфотерность белков (знак заряда белковой молекулы – отрицательный или положительный - зависит от преобладания кислых или основных аминокислот в её составе).
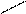
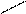 COOH NH2
COOH NH2

 R NH2 R COOH
R NH2 R COOH

 COOH NH2
COOH NH2
Вода в организме человека составляет 65%, а ВМС – 35%. Вода заполняет все пространства клеток и тканей, составляя внутреннюю среду организма, а ВМС находятся в ней, образуя растворы с особыми свойствами. По своим свойствам растворы ВМС в организме человека приближаются к коллоидным растворам.
Признаки коллоидного состояния.
1.Наличие двух фаз – дисперсной фазы и дисперсионной среды.
2.Наличие поверхности раздела между дисперсной фазой и дисперсионной средой.
3.Определённая степень раздробленности частиц (от 1 до 100 нм).
4.Определённая степень устойчивости, обусловленная двумя факторами – зарядом и водной оболочкой.
Устойчивость белков в биологических жидкостях организма обуславливают два фактора: заряд и водная оболочка для гидрофильных белков (альбумины) и только заряд – для гидрофобных белков (коллаген).
Строение белков.
Белки построены из аминокислот. Аминокислота содержит 2 основные группы: карбоксильную – СООН и аминогруппу NН2. Всего в создании белков участвует 22 аминокислоты, они связаны между собой в длинные цепи, которые образуют основу белковой молекулы.
Все аминокислоты, входящие в состав белков человека, относятся к α- аминокислотам, т.е. карбоксильная и аминогруппа присоединены к одному и тому же углеродному атому в α- положении:
β a




 R СН2 СН СООН R СН СООН -
R СН2 СН СООН R СН СООН -
NH2 NH2+

 СООН группа – карбоксильная - придает данной кислоте кислое свойство и «-» отрицательный заряд.
СООН группа – карбоксильная - придает данной кислоте кислое свойство и «-» отрицательный заряд.
NH2 – аминогруппа– дает аминокислоте основные свойства и в электрическом поле «+» заряд.
Свойства аминокислот, проявлять себя, как в кислой, так и в основной реакции называется амфотерностью.
Аминокислоты различаются радикалами (R), т.е. аминокислотными остатками и количеством функционирующих групп (СООН и NН2).
Структура белковой молекулы
Белки построены по единому принципу и имеют 4 уровня организации:
I уровень. Первичная структура
- линейная цепь аминокислот, расположена в определенной последовательности и соединяется между собой пептидными связями (ковалентная пептидная связь).
Основа цепи – многократно повторяющаяся последовательность – СО – СН – NH- Радикалы расположены вне цепи, именно они несут главную нагрузку при выполнении белками их функций.
Аминокислотный остаток, на одном конце пептида, где имеется a-аминная группа- аминоконцевым или N-концевым остатком.
На противоположном конце молекулы, имеющим свободную карбоксильную группу – карбоксиконцевой или С-концевой. Название пептидов образуется из входящих в них аминокислот остатков в соответствие с их последовательностью, начиная с N – конца.
Каждый белок имеет в своем составе определенное количество аминокислот, соединенных между собой в строго зафиксированной последовательности с помощью пептидных (ковалентных) связей, что и определяет специфичность и уникальность каждого белка.
Первым белком, у которого была определена первичная структура, стал инсулин, содержащий 51 аминокислоту = > что позволило получить его искусственным путем.
II уровень. Вторичная структура
– спираль, в которой закручивается полипептидная цепочка.
Спирализация возможна благодаря водородным связям между остатками карбоксильных и аминных групп.
Основа альфа – спирали – пептидная цепь, а радикалы аминокислот направлены к наружи, располагаются по спирали. Внешне альфа-спираль похожа на растянутую спираль электроплитки. Такая форма характерна для белков, имеющих 1 полипептидную цепь (альбумины, глобулины).
Складчатая β- структура – плоская форма, похожа на меха гармошки.
Характерна для белков, имеющих несколько полипептидных цепей, расположенных параллельно.
β- структура встречается в таких белках, как трипсин, рибонукмаза, кератин волос, коллаген, сухожилий.
Водородная связь слабая, легко образуется и легко разрывается (в белках этот вид связи: между Н альфа-аминной группы одной пептидной связи и О2 β – карбоксильной группы другой).
В образовании вторичной структуры белковой молекулы принимают участие и дисульфидные связи (образованы между сульфгидрильными группами цистеина).
III уровень.Третичная структура
– пространственная форма, которую стремится принять спираль вторичной структуры, складываясь и изгибаясь под действием образования дополнительных дисульфидных связей (дисульфидных мостиков, которые образуются между атомами серы двух молекул цистеина, расположенные в разных участках полипептидной цепи) – связь очень прочная (только сильные кислоты, щелочи, алкоголь, высокая температура может разрушить – S - S).
! Именно третичная структура обеспечивает выполнение белком его основных функций и может быть представлена в виде шарика (глобулы), яичный белок, казеин молока, белки сыворотки крови (альбумины, глобулины) и в виде нитей (фибрилл: белки опорных тканей: миозин мышц, оссеин костей, фибрин крови.
Глобулярные белки хорошо растворимы в воде. Фибриллярные плохо или совсем не растворяются.
Итак, третичную структуру поддерживают четыре вида связи:
1)водородные (Н . . . О);
2)Ионные (солеобразующие) –NH 3 ….C
3)Дисульфидные – S-S -;
4)Гидрофобные (силы Ван-дер-Ваальса).
IV уровень. Четвертичная структура
– характерна для белков состоящих из 2 или более полипептидных цепей, связанных между собой слабыми ионными связями. Это объединение в определённом порядке двух или более субъединиц в молекулу олигомерного белка.
Дата добавления: 2016-02-09; просмотров: 10043;
