Линейчатый спектр атома водорода
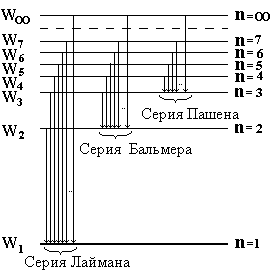 Рис. 2.1
Рис. 2.1
|
Спектром называют совокупность (сплошная, дискретная) монохроматических колебаний, излучаемых или поглощаемых каким-либо телом.
Любые светящиеся газы дают линейчатые спектры испускания. Изучая линейчатые спектры атома водорода, Бальмер получил формулу 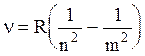 , (2.1)
, (2.1)
где m и n - квантовые числа; n - частота испущенного (поглощенного) кванта;
R = 3,29×1015 с-1 - постоянная Ридберга.
Ридберг показал, что в линейчатых спектрах не только атома водорода, но и атомах других элементов наблюдаются спектральные серии. В частности, для водорода из множества серий можно выделить спектральные серии (рис. 2.1): I. серия Лаймана (ультрафиолетовый спектр) 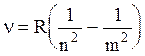 , где n = 1, m = 2, 3, 4, ... . II. серия Бальмера (видимый спектр)
, где n = 1, m = 2, 3, 4, ... . II. серия Бальмера (видимый спектр) 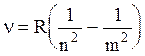 , где n =2, m =3, 4, 5, ... .III. серия Пашена (инфракрасный спектр)
, где n =2, m =3, 4, 5, ... .III. серия Пашена (инфракрасный спектр) 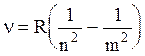 , где n=3, m=4, 5,.… и т. д.
, где n=3, m=4, 5,.… и т. д.
В спектре поглощения водорода наблюдается только серия Лаймана, т. к. она соответствует квантовым переходам атома из основного состояния в другие возбужденные. Спектральные частоты водородоподобных ионов можно найти по формуле 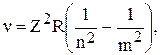 где
где 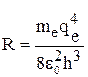 ; Z - порядковый номер в периодической системе элементов Д. И. Менделеева.
; Z - порядковый номер в периодической системе элементов Д. И. Менделеева.
Следовательно, спектральные серии водородоподобных ионов смещаются относительно спектральных серий атома водорода.
При соединении атомов в молекулы и кристаллы внешние оболочки атомов сильно искажаются, поэтому оптические и инфракрасные спектры молекул являются полосатыми, а металлов сплошными.
Атом можно возбудить и путем удаления одного из электронов внутренней заполненной оболочки. На электрон глубокой оболочки в основном действует кулоновское притяжение ядра, лишь слегка экранированное другими электронами. Это экранирование учитывается заменой заряда ядра на (Z - s)e, где s - поправочный коэффициет (s << Z) и различен для глубоких оболочек.
В этом случае частота излучения при переходах на глубокие оболочки определяется по формуле 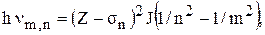
где J – постоянная (ионизационный потенциал).
Серии излучения лежат в рентгеновской области электромагнитного спектра. Наблюдаемое при электронных переходах на глубокие уровни атома рентгеновское излучение называют характеристическим, поскольку это излучение зависит от энергетического спектра электронов в атоме.
Для отдельной серии, т. е. при фиксированном n частота излучения находится по формуле (закон) Мозли 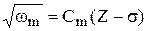 , где Сm - постоянная.
, где Сm - постоянная.
Закон Мозли позволяет по частотам характеристического рентгеновского излучения атомов устанавливать их номера, что сыграло положительную роль при определении мест элементов в периодической системе Д. И. Менделеева.
Постулаты Бора
Для объяснения устойчивости атомов, их линейчатых спектров и других свойств атомов Бор предложил использовать постулаты:
1) . Существует стационарные состояния атома, находясь в котором он не излучает энергии.
2) . В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь квантованное значение момента импульса, т.е.
Ln= mvr = n 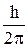 , (2.2)
, (2.2)
где m - масса электрона; v - его скорость; r - радиус орбиты; h - постоянная Планка.
Как показала квантовая теория, n = 1, 2, 3, ... , - главное квантовое число, характеризует энергетические уровни атомов.
3) . При переходе электрона в атоме с высшего возбужденного энергетического уровня Wm на низший Wn испускается квант энергии
e = hnmn= DW = Wm - Wn. (2.3)
При поглощении кванта энергии e = hnmn атомом электрон переходит с энергетического уровня Wn на энергетический уровень Wm .
Уровень n = 1 - основной, невозбужденный уровень; уровни n = 2, 3, 4, ... , - возбужденные уровни.
Первый потенциал возбуждения атома 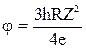 .
.
Полная энергия электрона в атоме
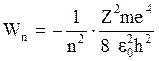 , (2.4)
, (2.4)
где m - масса электрона; e0 - электрическая постоянная. При n ® ¥, Wn ® 0.
Абсолютное значение Wn в формуле (2.4) называют энергией связи электрона в атоме, находящегося в состоянии n.
Поэтому уровень 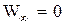 соответствует энергии ионизации атома водорода, т. е. отрыву электрона. Энергию ионизации атома связывают с потенциалом ионизации j, т. е. Wион= |е|j|. (2.5)
соответствует энергии ионизации атома водорода, т. е. отрыву электрона. Энергию ионизации атома связывают с потенциалом ионизации j, т. е. Wион= |е|j|. (2.5)
Частоту n излученного (поглощенного) кванта находят по формуле (2.1).
Для атома водорода при n = 1 потенциал ионизации j = 13,53 В,
W1= = -2,16×10-18 Дж = - 13,53 эВ.
Радиусы боровских орбит электрона в водородоподобных атомах можно вычислить по формуле 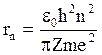 ,
,
где e0 – электрическая постоянная; h – постоянная Планка; n – главное квантовое число; Z – порядковый номер в периодической системе элементов Д. И. Менделеева; m - масса электрона; е – элементарный заряд.
Первый боровский радиус электрона, который характеризует в среднем размер атома водорода r1 @5,29×10-11 м. Размер атома определяется его электронной оболочкой. Скорость обращения электрона по боровской орбите вычисляют по формуле 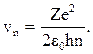 Для атома водорода скорость электрона на 1- й боровской орбите v1 = 2,2×106 м/с (n = 1).
Для атома водорода скорость электрона на 1- й боровской орбите v1 = 2,2×106 м/с (n = 1).
Дата добавления: 2016-02-04; просмотров: 2650;
