Механизм токсического действия и патогенез интоксикации
ФОВ относятся к типичным антихолинэстеразным веществам, действие которых связано с прекращением ферментативного гидролиза ацетилхолина (АХ), осуществляющего передачу нервных импульсов в холинэргических синапсах. Таким образом, ФОВ могут быть отнесены к медиаторным ядам. Отсюда следует, что для понимания механизма их действия на человека необходимо располагать современными данными о строении и функции синапсов и о роли АХ в процессах передачи нервных импульсов.
Синапс – место контакта окончания нервного волокна с другим нейроном или с органом. Синапсы обеспечивают передачу нервного импульса на другой нейрон или орган (причем только в одном направлении). К холинергическим нервам относятся:
1. все двигательные нервы, иннервирующие поперечнополосатую мускулатуру;
2. все преганглионарные вегетативные нервные волокна (как симпатические, так и парасимпатические);
3. все постганглионарные парасимпатические волокна;
4. постганглионарные симпатические волокна, иннервирующие потовые железы;
5. холинореактивные структуры ЦНС.
В состав синапса входят нервное окончание (пресинаптическая мембрана), синаптическая щель и часть второй нервной клетки или эффекторного органа (постсинаптическая мембрана) (рис. 1). Внутри нервного окончания имеются многочисленные пузырьки, содержащие АХ с помощью которого осуществляется процесс химической передачи нервного импульса через синапс. Нервный импульс, достигая нервного окончания, вызывает выделение из синаптических пузырьков медиатора – АХ, кванты которого устремляются через синаптическую щель к поситсинаптической мембране, в которой находятся холинореактивные системы (холинорецепторы – ХР).
Холинорецептор – белковолипидный комплекс, входящий в состав постсинаптической мембраны, является той структурой, в которой происходит реализация биохимического действия медиатора и различных фармакологических агентов в физиологический процесс. Образование комплекса ХР + АХ приводит к изменению конфигурации рецепторного белка, что вызывает изменение проницаемости постсинаптической мембраны для ионов. В результате ионы Na+ начинают диффундировать из внешней среды в клетку, а ионы K+ устремляются из клетки во внешнюю среду. Этот процесс приводит к деполяризации постсинаптической мембраны и генерирует возбуждающий постсинаптический потенциал действия, передающийся на рецепторную систему.
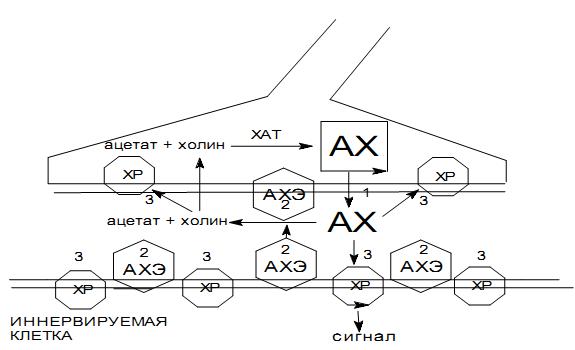
Рис. 1. Схема функционирования холинэргического синапса 1‑ АХ (ацетилхолин), 2‑ АХЭ (ацетилхолинэстераза), 3‑ ХР (холинорецептор)
Нормальное функционирование синапса возможно в случае, если действие АХ на ХР постсинаптической мембраны, будет немедленно устраняться, в противном случае возникнет длительная деполяризация постсинаптической мембраны и передача импульсов через синапс станет невозможной. Быстрое расщепление АХ обеспечивается ферментом ацетилхолинэстеразой (АХЭ). После расщепления ацетилхолина ферментом АХЭ свойства белка холинорецептора возвращаются в «исходное» состояние. При этом происходит поляризация постсинаптической мембраны за счет выхода ионов Na+ под действием «натриевого насоса» и готовность синапса к проведению следующего нервного импульса восстанавливается.
Фермент АХЭ гидролизует АХ на уксусную кислоту и холин. Без этого невозможен нормальный процесс передачи нервного импульса в холинергическом синапсе. Истинная АХЭ находится преимущественно в эритроцитах и нервной ткани. Является ферментом, синтезируемым печеночными клетками (определение активности АХЭ в сыворотке крови широко используется при отравлении ФОС и заболеваниях печени – острый гепатит, цирроз печени и др.). На активном центре АХЭ имеется два активных участка: анионный и эстеразный. Анионный выполняет ориентирующую роль, способствует сближению субстрата с ферментом и обеспечивает нужную ориентацию молекулы АХ на активной поверхности холинэстеразы. На эстеразном участке фермента АХЭ протекает собственно гидролиз АХ.
Таким образом, в итоге реакции взаимодействия АХЭ с ацетилхолином образуется ацетилированный фермент – непрочное соединение, быстро подвергающееся гидролизу с образованием холина, уксусной кислоты и интактного фермента, готового к взаимодействию с новой молекулой субстрата. Эта ферментативная реакция расщепления молекулы АХ происходит с высокой скоростью (60–90 мс).
Знание механизма расщепления субстрата АХЭ важно для понимания реакции угнетения фермента фосфорорганическими ядами (рис. 2). В молекуле ФОВ присутствует группировкаР=О:, которая своей поляризацией напоминает карбонильную(С=О:) группу ацетилхолина. Сдвиг электронов в сторону кислорода создает на атоме фосфора дефицит электронной плотности и тем самым облегчает его взаимодействие с атомом кислорода гидроксильной группы (‑ОН) серина, образующего эстеразный участок фермента АХЭ. В результате этого взаимодействия происходит разрыв связи между фтором и фосфором, причем фосфорсодержащая часть яда присоединяется к ферменту, а фтор, соединившись с атомом водорода, образует фтористый водород (HF).
Взаимодействие между ФОВ и АХЭ является сложной многоступенчатой реакцией. Сначала образуется обратимый комплекс ФОВ с энзимом (ХЭ + ФОВ ХЭ • ФОВ), который существует считанные доли секунды, затем происходит фосфорилирование с образованием прочного фосфорилированного энзима и продукта реакции – остатка фосфорорганического ингибитора. Эта реакция протекает в течение 1,5 – 2 часов. Через 4–5 часов фосфорилированный энзим подвергается «старению», которое почти исключает возможность его дефосфорилирования (необратимое соединение). Эта реакция приводит к необратимому угнетению каталитической функции АХЭ, накоплению эндогенного АХ и непрерывному возбуждению холинореактивных систем организма.
Еще более сильное антихолинэстеразное действие оказывают ФОВ типа Vx‑газов, которые благодаря наличию аминотиоловой группы (R1‑S‑CH2‑CH2‑N+‑R3) соединяются не только с эстеразным, но и с анионным участком фермента.
Таким образом, взаимодействие фермента с ФОВ проходит по тому же механизму, что и с ацетилхолином. Взаимодействие ацетилхолина, зарина и VX с активным центром АХЭ показано на рис. 2.
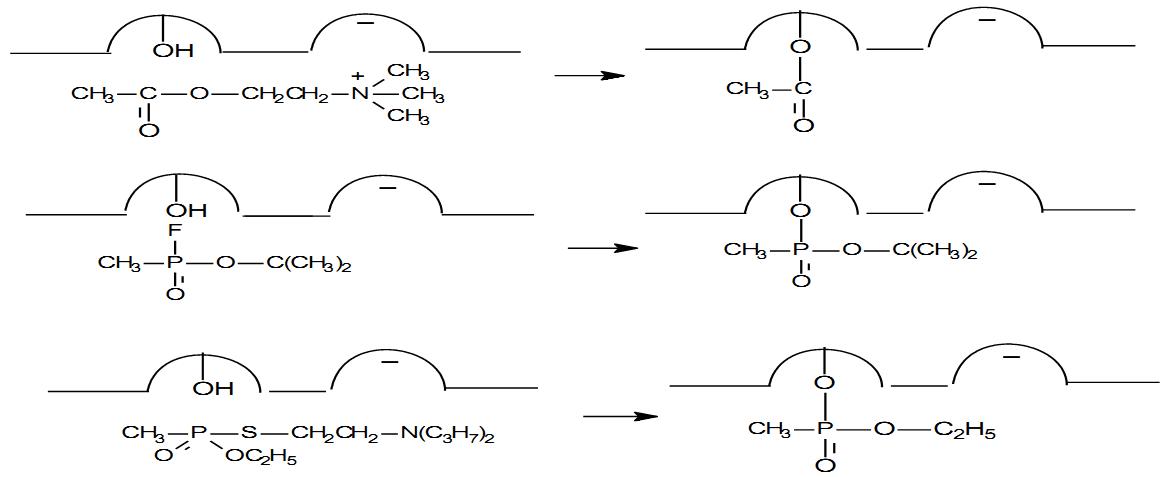
Рис. 2. Схема взаимодействия ацетилхолина, зарина и фосфорилтиохолина с активным центром АХЭ При остром отравлении ФОВ существует определенная (хотя и не полная) корреляция между степенью угнетения активности АХЭ и тяжестью интоксикации.
Механизмы неантихолинэстеразного действия ФОВ. Антихолинэстеразный механизм действия ФОВ является ведущим, но не единственным. Из других неантихолинэстеразных механизмов действия наиболее важным является действие ФОВ на холинорецепторы. Поскольку и холинорецепторы, и холинэстераза адаптированы к одному и тому же нейромедиатору, ингибиторы холинэстеразы могут проявить активность и по отношению к холинорецепторам. Этим объясняется, что тяжесть клиники не всегда строго параллельна степени подавления активности АХЭ.
ФОВ способны вызывать сенсибилизацию ХР по отношению к ацетилхолину, что объясняет рецидивы клиники поражения через много дней после контакта с ФОВ, когда яда в организме уже не обнаруживается. ФОВ приводят к ускоренному высвобождению АХ из синаптических пузырьков, повышению его концентрации на пресинаптической мембране, где обнаружены М‑холинорецепторы.
Возбуждение пресинаптических структур ведет к ускоренному выбросу АХ.
Помимо действия на холинореактивные структуры ФОВ, в высоких дозах, обладают прямым повреждающим действием на клетки различных органов и тканей (нервной системы, печени, почек, системы крови и т. д.), в основе которого лежат общие механизмы цитотоксичности: нарушение энергетического обмена клетки; нарушение гомеостаза внутриклеточного кальция; активация свободнорадикальных процессов в клетке.
Дата добавления: 2016-02-02; просмотров: 1446;
