Значения квантовых чисел и максимальное число электронов на квантовых уровнях и подуровнях
| Квантовый | Магнитное квантовое число ml | Число квантовых состояний (орбиталей) | Максима-льное число электронов | |||||
| уровень | подуровень | |||||||
| обозна-чение | главное квантовое число n | обозна-чение | орбиталь-ное квантовое число l | в подуровне (2/+1) | в уровне n2 | в подуровне (2/+1) | в уровне 2n2 | |
| K | s | |||||||
| L | s p | -1; 0;+1 | ||||||
| M | s p d | -1; 0;+1;+2 -2;-1; 0;+1; | ||||||
| N | s p d f | -1; 0;+1 -2;-1; 0;+1;+2 -3;-2;-1; 0;+1; +2;+3; |
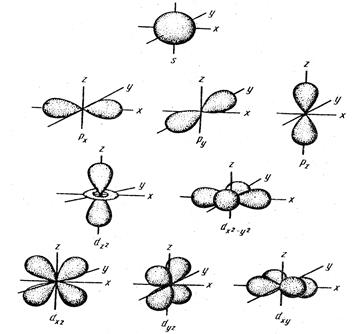
Рис. 1. Формы s-, p- и d- электронных облаков (орбиталей)
Пример 2. Составьте электронные формулы атомов элементов с порядковыми номерами 16 и 22. Покажите распределение электронов этих атомов по квантовым (энергетическим) ячейкам.
Решение. Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nlx, где n – главное квантовое число, l – орбитальное квантовое число (вместо него указывают соответствующее буквенное обозначение – s, p, d, f), x – число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией – меньшая сумма n+1 (правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:

Так как число электронов в атоме того или иного элемента равно его порядковому номеру в таблице Д.И. Менделеева, то для элементов №16 (сера) и №22 (титан) электронные формулы имеют вид:
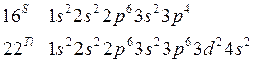
Электронная структура атома может быть изображена также в виде схем размещения электронов в квантовых (энергетических) ячейках, которые являются схематическим изображением атомных орбиталей (АО). Квантовую ячейку обозначают в виде прямоугольника  , кружка
, кружка  или линейки
или линейки  , а электроны в этих ячейках обозначают стрелками. В каждой квантовой ячейке может быть не более двух электронов с противоположными спинами
, а электроны в этих ячейках обозначают стрелками. В каждой квантовой ячейке может быть не более двух электронов с противоположными спинами  ,
,  или
или  . В данном пособии применяют прямоугольники. Орбитали данного подуровня заполняются сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами (правило Хунда):
. В данном пособии применяют прямоугольники. Орбитали данного подуровня заполняются сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами (правило Хунда):
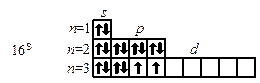
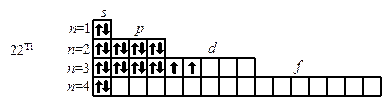
Пример 3. Изотоп 101-го элемента – менделевия (256) был получен бомбардировкой a-частицами ядер атомов эйнштейния (253). Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме.
Решение. Превращение атомных ядер обусловливается их взаимодействием с элементарными частицами или друг с другом. Ядерные реакции связаны с изменением состава ядер атомов химических элементов. С помощью ядерных реакций можно из атомов одних элементов получить атомы других.
Превращения атомных ядер как при естественной, так и при искусственной радиоактивности записывают в виде уравнений ядерных реакций. При этом следует помнить, что суммы массовых чисел (цифры, стоящие у символа элемента вверху слева) и алгебраические суммы зарядов (цифры, стоящие у символа элемента внизу слева) частиц в левой и правой частях равенства должны быть равны. Данную ядерную реакцию выражают уравнением:
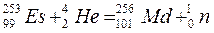
Часто применяют сокращенную форму записи. Для приведенной реакции она имеет вид: 253Es(a, n)256Md. В скобках на первом месте пишут бомбардирующую частицу, а на втором, через запятую, - частицу, образующуюся при данном процессе. В сокращенных уравнениях частицы 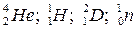 обозначают соответственно a, p, d, n.
обозначают соответственно a, p, d, n.
Пример 4. Исходя из сокращенных уравнений ядерных реакций (табл. 2), напишите их полные уравнения.
Решение. Ответ на вопрос отражен в табл. 2.
Таблица 2.
Дата добавления: 2016-02-02; просмотров: 1116;
