I. По табличным значениям.
В настоящее время известны стандартные теплоты образования ∆Н0f и энтропия S0298 , более 7500 простых веществ и соединений. С помощью этих табличных значений можно вычислить термодинамические параметры (∆Н0298 ,∆S0298 и ∆G0298) многих десятков тысяч реакций, в том числе предполагаемых и не изученных экспериментально. В методе расчета, основанном на использовании стандартных термодинамических величин, используются два исходных уравнения:
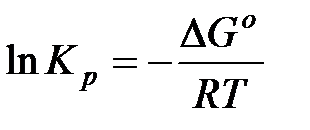
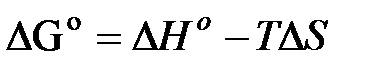
а также уравнения для процессов:
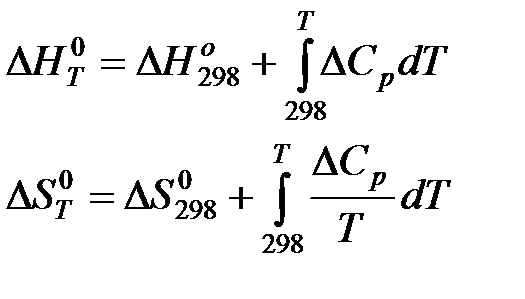
Расчет ΔG при заданной температуре.
а) Первое приближение Улиха.
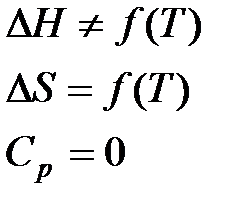
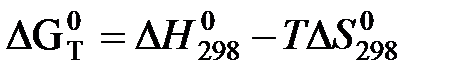 (грубое приближенное уравнение
(грубое приближенное уравнение 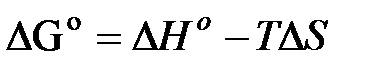 )
)
Данное приближение решение необходимо для быстрой оценки возможности реакции при интересующей нас температуре и положения равновесия.
б) Второе приближение Улиха.
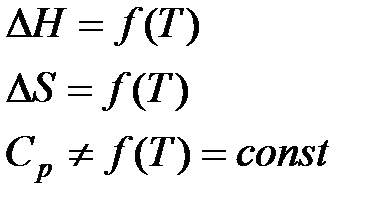
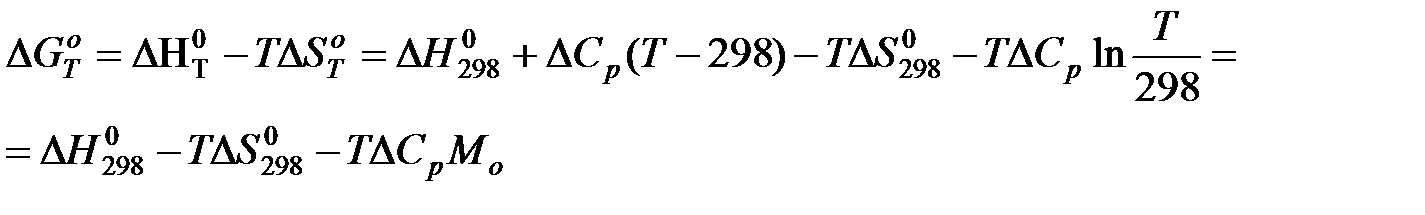
Где 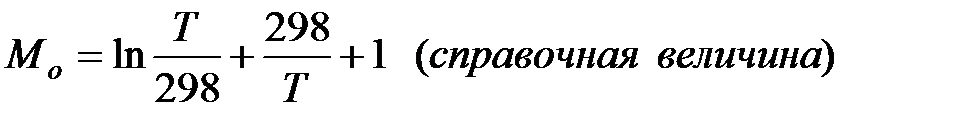
Второе приближение используется в случае, если не требуется особой точности в определении положения равновесия.
в) Метод Шварцмана-Темкина.
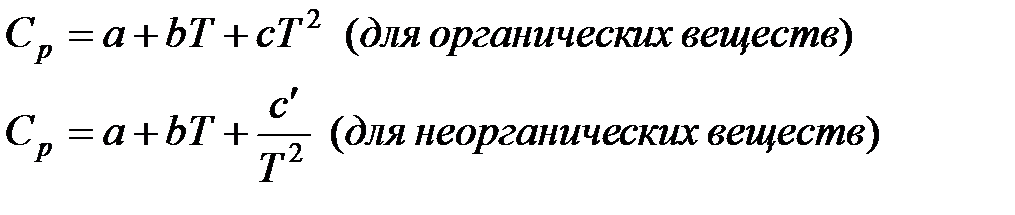
Проведем первое интегрирование уравнения 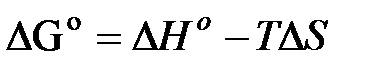 и получим:
и получим:
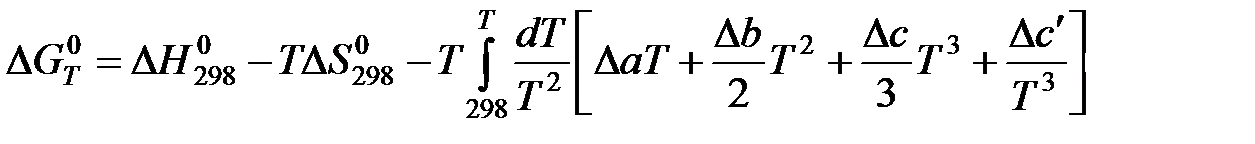
Проведем второе интегрирование и, собрав все члены с общими множителями 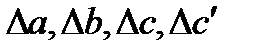 , будем иметь:
, будем иметь:
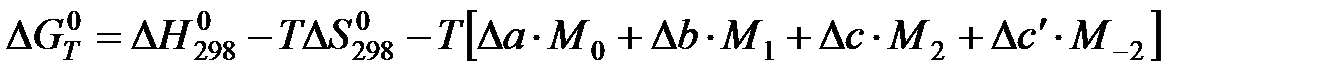
АЛГОРИТМ РАСЧЕТА Кр
1.Составляем таблицу термодинамических величин: aA + bB ↔ cC + dD
| Вещество | ∆Н0f , Дж/(моль*К) | S0298, Дж/(моль*К) | Ср, Дж/(моль*К) | а | b | c |
| А | ||||||
| В | ||||||
| С | ||||||
| D |
2.проводим расчет т.д. параметров при стандартных условиях:
∆Н0298 =∑(ni∆Н0f )кон — ∑(ni∆Н0f )нач;
∆ S0298=∑( ni S0298)кон — ∑( ni S0298)нач;
∆Ср=∑( ni Ср)кон — ∑( ni Ср)нач;
∆a=∑( ni a)кон — ∑( ni a)нач;
∆b=∑( ni b)кон — ∑( ni Ср)нач;
∆c=∑( ni c)кон — ∑( ni c)нач.
3.Расчет изменения энергии Гиббса 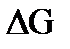 :
:
а) при стандартных условиях:
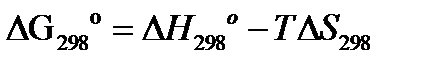
б) при интересующей нас температуре Т
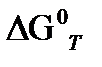 ( а) по первому приближению Улих;.
( а) по первому приближению Улих;.
б) Второму приближение Улих;.
в) Метод Шварцмана-Темкина)
4. Расчет константы равновесия Кр:
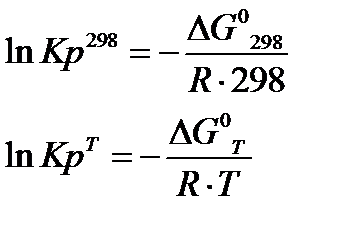
Дата добавления: 2016-02-02; просмотров: 1722;
