Титриметрический анализ. Химический эквивалент вещества. Молярная концентрация эквивалента вещества. Закон эквивалентов. Точка эквивалентности и способы её фиксирования.
Титриметрический анализ - метод количественного анализа, основанный на измерении объёма раствора с точно известной концентрацией реактива, требующегося для реакции с данным количеством определяемого вещества (см. также Объёмный анализ).
Химический эквивалент— это некая реальная или условная частица, которая может присоединять, высвобождать или быть каким-либо другим образом эквивалентна одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях.
Фактор эквивалентности может быть равен или меньше единицы: fэкв.= 1/z, где z – основность кислоты или кислотность основания в данной кислотно-основной реакции, число отданных или принятых электронов в окислительно-восстановительных реакциях.
Молярная концентрация эквивалента C(l/z X) показывает количество вещества эквивалента (в молях), которое содержится в 1 л раствора. C(l/z X) равна отношению количества вещества эквивалента в растворе к объему этого раствора. 
Закон эквивалентов -Вещества реагируют друг с другом в количествах, равных их эквивалентвм,
Точка эквивалентности (в титриметрическом анализе) — момент титрования, когда число эквивалентов добавляемого титранта эквивалентно или равно числу эквивалентов определяемого вещества в образце.
В ряде случаев окислительно-восстановительного титрования точки эквивалентности фиксируют по изменению окраски титруемого раствора, вызываемой избытком окрашенного стандартного раствора (например, перманганата).
Теоретические основы кислотно-основного титрования (метод нейтрализации). Рабочие растворы, индикаторы. Кривые титрования, выбор индикатора. Расчет молярной концентрации эквивалента и титра растворов кислот и щелочей в методе нейтрализации.
Кислотно-основное титрование — это титриметрический метод анализа, основанный на взаимодействии кислот и оснований. В качестве титрантов могут применяться сильные кислоты (ацидиметрия) или сильные основания (алкалиметрия). Прямым титрованием определяют концентрацию кислот или оснований или содержание элементов, входящих в их состав.Обратным титрованием или косвенными методами находят содержание некоторых солей(например, солей аммония или кальция).
Индикаторами называются вещества, изменяющие свою окраску в зави-симости от pH среды. По своей химической природе индикаторы представ-ляют собой с л а б ы е кислоты HJnd или с л а б ы е основания JndOH, у которых молекулярная и ионная формы имеют различную окраску.
Для построения кривой титрования рассчитывают рН в различные моменты титрования по формулам, приведенным выше. Кривая титрования характеризуется резким изменением рН в близи точки эквивалентности, которую называют скачком титрования. Чем больше скачок, тем точнее можно оттитровать определяемое вещество. По величине скачка выбирают индикатор. Основное правило выбора индикатора. Для каждого данного титрования можно применять только такие индикаторы, показатель титрования которых (рТ индикатора) лежит в пределах скачка рН на кривой титрования.
При кислотно-основном титровании наиболее точные результаты получаются при работе с 0, 1 н. растворами кислот и щелочей. При таких концентрациях на кривой титрования наблюдается 
 максимальный скачок титрования.
максимальный скачок титрования.
Скачок титрования-резкое изменение рН раствора вблизи точки эквивалентности. Скачок титрования вызван добавлением в титруемому раствору слабой кислоты при титровании последней капли щелочи. Величиной скачка титрования считают изменение рН раствора между состояниями, когда раствор недотитрован и перетитрован на 0,1%. Точка эквивалентности лежит в середине скачка титрования.
Для установления точки эквивалентности в титрометрическом анализе применяют индикаторы. Индикаторы метода нейтрализации – сложные органические вещества со слабыми кислотами или основными свойствами, имеющие различную окраску молекулярной и ионизированной форм. Индикаторы меняют окраску в зависимости от рН раствора. Интервал значений рН, в которым индикатор меняет свою окраску, называют интервалом перехода окраски индикатора.
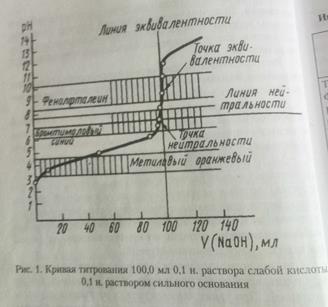
При выборе индикатора руководствуются основными правилом: интервал перехода окраски индикатора должен укладываться в интервал значений рН скачка титрования в данном случае.
Согласно этому, для определения эквивалентной точки в условиях задачи надо использовать индикаторы, интервал перехода окраски которых лежит в пределах рН от 8,0 до 10,0; например, фенолфталеин, тимолфталеин.
При этом следует учитывать особенности зрительного аппарата человека, который более четко воспринимает переход окраски раствора от более светлой к более темной, чем наоборот.
Поэтому в данной задаче использовать в качестве индикаторы фенолфталеин, в присутствии которого осуществляется переход окраски растворы от бесцветной к малиновой.
Оксидиметрия. Перманганатометрия. Рабочие растворы, индикаторы. Химические реакции, лежащие в основе метода. Расчет молярной концентрации эквивалента и титра растворов окислителей и восстановителей в методе оксидиметрии.
Оксидиметрия( от нем. oxydiren — окислять и ...метрия) — титриметрические методы в аналитической химии, основанные на реакциях окисления-восстановления. В процессе титрования изменяется окислительно-восстановительный потенциал системы, вблизи точки эквивалентности наблюдается резкое изменение потенциала.
Перманганатометрией называется метод объемного анализа, в котором в качестве рабочего раствора применяют перманганат калия КМп04. Перманганат калия является сильным окислителем, особенно в кислой среде.



Оксидиметрия. Йодометрия. Рабочие растворы, индикаторы. Химические реакции, лежащие в основе метода. Расчет молярной концентрации эквивалента и титра растворов окислителей и восстановителей в методе йодометрии.
Оксидиметрия ( от нем. oxydiren — окислять и ...метрия) — титриметрические методы в аналитической химии, основанные на реакциях окисления-восстановления. В процессе титрования изменяется окислительно-восстановительный потенциал системы, вблизи точки эквивалентности наблюдается резкое изменение потенциала. Оксидиметрию классифицируют в зависимости от применяемого в данной реакции раствора вещества — окислителя или восстановителя. К оксидиметрии относятся перманганатометрия, цериметрия, хроматометрия иодометрия и др.
1. Определение окислителей. Методом йодометрии можно определять те окислители, которые количественно окисляют 1~ в свободный 12. Чаще всего определяют перманганаты, бихроматы, соли меди (II), соли железа (III), свободные галогены и др.
Окислитель реагирует с избытком йодида калия КД в кислой среде. При этом выделяется количество йода, эквивалентное количеству окислителя. Выделившийся йод титруют раствором тиосульфата натрия точно известной нормальности. Таким образом, можно рассчитать количество определяемого окислителя, которое будет эквивалентно количеству тиосульфата, пошедшего на титрование йода. Следовательно, рабочим раствором в этом методе будет раствор тиосульфата натрия
Индикатором в методе йодометрии служит раствор крахмала. Это чувствительный и специфический индикатор, образующий с йодом адсорбционное соединение синего цвета. Однако употребление этого индикатора имеет некоторые особенности. Во-первых, раствор крахмала необходимо прибавлять в самом конце титрования, когда йода останется очень мало и титруемый раствор будет иметь светло-желтую окраску. Если прибавить крахмал раньше, когда йода в растворе еще много, то образующееся соединение йода с крахмалом очень медленно реагирует с тиосульфатом и раствор легко перетитровать. Вторая особенность обусловлена тем, что в данном случае мы титруем не до появления окраски (как это обычно бывает), а до исчезновения окраски. Поэтому вблизи точки конца титрования необходимо прибавлять раствор не более чем по одной капле, после каждой капли тщательно перемешивать раствор и ждать 3—5 с. Если не соблюдать это условие, раствор очень легко перетитровать.
2. Определение восстановителей. Из числа восстановителей этим методом чаще всего определяют сульфиты, сульфиды, хлорид олова (II) и др. Рабочим раствором является раствор йода 12. В качестве исходного вещества для установки титра раствора йода применяют мышьяковистый ангидрид As203, который растворяют в щелочи п получают арсенит (ион As02). Титрование проводят в очень слабощелочной среде (рН<8,0). Практически это достигается прибавлением раствора гидрокарбоната натрия NaHC03 к раствору, имеющему нейтральную или слабокислую реакцию. Индикатор крахмал.

Дата добавления: 2016-02-02; просмотров: 7962;
