Общая характеристика IVA группы Периодической системы.
В IVA группе находятся самые важные элементы, без которых не было бы ни нас, ни Земли, на которой мы живем. Это углерод – основа всей органической жизни, и кремний – «монарх» царства минералов.
Если углерод и кремний – типичные неметаллы, а олово и свинец – металлы, то германий занимает промежуточное положение. Одни учебники относят его к неметаллам, а другие – к металлам. Он серебристо-белого цвета и внешне похож на металл, но имеет алмазоподобную кристаллическую решетку и является полупроводником, как и кремний.
От углерода к свинцу (с уменьшением неметаллических свойств):
w уменьшается устойчивость отрицательной степени окисления (-4)
w уменьшается устойчивость высшей положительной степени окисления (+4)
w увеличивается устойчивость низкой положительной степени окисления (+2)
Углерод – основная составная часть всех организмов. В природе встречаются как простые вещества, образованные углеродом (алмаз, графит), так и соединения (углекислый газ, различные карбонаты, метан и другие углеводороды в составе природного газа и нефти). Массовая доля углерода в каменных углях доходит до 97 %.
Атом углерода в основном состоянии может образовать две ковалентных связи по обменному механизму, но в обычных условиях такие соединения не образуются. Атом углерода, переходя в возбужденное состояние, использует все четыре валентных электрона.
Углерод образует довольно много аллотропных модификаций (см. рис. 16.2). Это алмаз, графит, карбин, различные фуллерены.
В неорганических веществах степень окисления углерода +II и +IV. С такими степенями окисления углерода существуют два оксида.
Оксид углерода(II) – бесцветный ядовитый газ, без запаха. Тривиальное название – угарный газ. Образуется при неполном сгорании углеродсодержащего горючего. Электронное строение его молекулы см. на стр. 121. По химическим свойствам CO несолеобразующий оксид, при нагревании проявляет восстановительные свойства (восстанавливает до металла многие оксиды не очень активных металлов).
Оксид углерода(IV) – бесцветный газ без запаха. Тривиальное название – углекислый газ. Кислотный оксид. В воде малорастворим (физически), частично реагирует с ней, образуя угольную кислоту H2CO3(молекулы этого вещества существуют только в очень разбавленных водных растворах).
Угольная кислота – кислота очень слабая, двухосновная, образует два ряда солей (карбонаты и гидрокарбонаты). Большинство карбонатов нерастворимо в воде. Из гидрокарбонатов как индивидуальные вещества существуют только гидрокарбонаты щелочных металлов и аммония. И карбонат-ион, и гидрокарбонат-ион – частицы основания, поэтому и карбонаты, и гидрокарбонаты в водных растворах подвергаются гидролизу по аниону.
Из карбонатов наибольшее значение имеют карбонат натрия Na2CO3 (сода, кальцинированная сода, стиральная сода), гидрокарбонат натрия NaHCO3 (питьевая сода, пищевая сода), карбонат калия K2CO3(поташ) и карбонат кальция CaCO3 (мел, мрамор, известняк).
Качественная реакция на присутствие в газовой смеси углекислого газа: образование осадка карбоната кальция при пропускании исследуемого газа через известковую воду (насыщенный раствор гидроксида кальция) и последующее растворение осадка при дальнейшем пропускании газа. Протекающие реакции:
Ca2 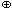 + 2OH
+ 2OH 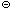 +CO2 = CaCO3 + H2O;
+CO2 = CaCO3 + H2O;
CaCO3 + CO2 + H2O = Ca2 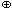 +2HCO3
+2HCO3 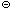 .
.
По содержанию в организме человека (21,15%) угле–род относится к макроэлементам. Он входит в состав всех тканей и клеток в форме белков, жиров, углево–дов, витаминов, гормонов. С биологической точки зре–ния углерод является органогеном номер 1.
В фармакологии и медицине широко используются различные соединения углерода — производные угольной кислоты и карбоновых кислот, различные гетероциклы, полимеры и другие соединения. Так, карболен (активированный уголь), применяется для абсорбции и выведения из организма различных токсинов; графит (в виде мазей) — для лечения кожных заболеваний; радиоактивные изотопы углерода — для научных исследований (радиоуглеродный анализ).
Углерод является основой всех органических веществ. Любой живой организм состоит в значительной степени из углерода. Углерод — основа жизни. Источником углерода для живых организмов обычно является СО2 из атмосферы или воды. В результате фотосинтеза он попадает в биологические пищевые цепи, в которых живые существа поедают друг друга или останки друг друга и тем самым добывают углерод для строительства собственного тела. Биологический цикл углерода заканчивается либо окислением и возвращением в атмосферу, либо захоронением в виде угля или нефти.
Аналитические реакции карбонат - иона СО32-
Карбонаты - соли нестабильной, очень слабой угольной кислоты Н2СО3, которая в свободном состоянии в водных растворах неустойчива и разлагается с выделением СО2: Н2СО3 -- СО2 + Н2О
Карбонаты аммония, натрия, рубидия, цезия растворимы в воде. Карбонат лития в воде мало растворим. Карбонаты остальных металлов мало растворимы в воде. Гидрокарбонаты растворяются в воде. Карбонат - ионы в водных растворах бесцветны, подвергаются гидролизу. Водные растворы гидрокарбонатов щелочных металлов не окрашиваются при прибавлении к ним капли раствора фенолфталеина, что позволяет отличить растворы карбонатов от растворов гидрокарбонатов (фармакопейный тест).
1.Реакция с хлоридом бария.
Ва2+ + СОз2- —> ВаСО3 (белый мелкокристаллический)
Аналогичные осадки карбонатов дают катионы кальция (СаСО3) и стронция (SrCO3). Осадок растворяется в минеральных кислотах и в уксусной кислоте. В растворе H2SO4 образуется белый осадок BaSO4.
К осадку медленно, по каплям прибавляют раствор НС1 до полного растворения осадка: ВаСОз + 2 НС1 ->• ВаС12+ СО2 + Н2О
2.Реакция с сульфатом магния (фармакопейная).
Mg2+ + СОз2- ->MgCO3 (белый)
Гидрокарбонат - ион НСО3- образует с сульфатом магния осадок MgCO3 только при кипячении: Mg2+ + 2 НСОз- -> MgCO3 + СО2 + Н2О
Осадок MgCO3 растворяется в кислотах.
3. Реакция с минеральными кислотами (фармакопейная).
СО32- + 2 Н3О = Н2СО3 + 2Н2О
НСО3- + Н3О+ = Н2СО3 + 2Н2О
Н2СО3 -- СО2 + Н2О
Выделяющийся газообразный СО2 обнаруживают по помутнению баритоновой или известковой воды в приборе для обнаружения газов, пузырьков газа (СО2), в пробирке - приемнике - помутнение раствора.
4.Реакция с гексацианоферратом (II) уранила.
2СО32- + (UО2)2[Fe(СN)6](коричневы)-> 2 UO2CO3 (бесцветный) + [Fe(CN)6]4-
Коричневый раствор гексацианоферрата (II) уранила получают, смешивая раствор ацетата уранила (CH3COO)2UO2 с раствором гексацианоферрата (II) калия:
2(СН3СОО)2ГО2 + K4[Fe(CN)6]-> (UO2)2[Fe(CN)6] + 4 СН3СООК
К полученному раствору прибавляют по каплям раствор Na2CO3 или К2СО3 при перемешивании до исчезновения коричневой окраски.
5.Раздельное открытие карбонат - ионов и гидрокарбонат - ионов реакциями с катионами кальция и с аммиаком.
Если в растворе одновременно присутствуют карбонат - ионы и гидрокарбонат - ионы, то каждый из них можно открыть раздельно.
Для этого вначале к анализируемому раствору прибавляют избыток раствора СаС12. При этом СОз2- осаждаются в виде СаСО3:
СОз2- + Са2+ = СаСО3
Гидрокарбонат - ионы остаются в растворе, так как Са(НСО3)2 растворами в воде. Осадок отделяют от раствора и к последнему добавляют раствор аммиака. НСО2- -анионы с аммиаком и катионами кальция дают снова осадок СаСО3: НСОз- + Са2+ + NH3 -> СаСОз + NH4+
6. Другие реакции карбонат - иона.
Карбонат - ионы при реакции с хлоридом железа (III) FeCl3 образуют бурый осадок Fe(OH)CO3, с нитратом серебра - белый осадок карбоната серебра Ag2CO3, растворимый в НЪТОз и разлагающийся при кипячении в воде до темного осадка Ag2O иСО2: Ag2CO3 -> Ag2O + СО2
Аналитические реакции ацетат - иона CH3COO'
Ацетат - ион СН3СОО- - анион слабой одноосновной уксусной кислоты СН3СООН: в водных растворах бесцветен, подвергается гидролизу, не обладает окислительно -восстановительными свойствами; довольно эффективный лиганд и образует устойчивые ацетатные комплексы с катионами многих металлов. При реакциях со спиртами в кислой среде дает сложные эфиры.
Ацетаты аммония, щелочных и большинства других металлов хорошо растворяется в воде. Ацетаты серебра CH3COOAg и ртути (I) менее ацетатов других металлов растворимы в воде.
1.Реакция с хлоридом железа (III) (фармакопейная).
При рН = 5-8 ацетат - ион с катионами Fe(III) образует растворимый темно - красный (цвета крепкого .чая) ацетат или оксиацетат железа (III).
В водном растворе он частично гидролизуется; подкисление раствора минеральными кислотами подавляет гидролиз и приводит к исчезновению красной окраски раствора.
3 СНзСООН + Fe -->• (CH3COO)3Fe + 3 Н+
При кипячении из раствора выпадает красно-бурый осадок основного ацетата железа (III):
(CH3COO)3Fe + 2 Н2О <- Fe(OH)2 CH3COO + 2 СН3СООН
В зависимости от соотношений концентраций железа (III) и ацетат - ионов состав осадка может изменяться и отвечать, например, формулам: Fe ОН (СН3СОО)2, Fe3(OH)2O3 (CH3COO), Fe3 О (ОН)( СН3СОО)6 или Fe3(OH)2 (СН3СОО)7.
Проведению реакции мешают анионы СО32-, SO3'-, РО43-, [Fe(CN)6]4, образующие осадки с железом (III), а также анионы SCN- (дающие красные комплексы с катионами Fe3+), иодид - ион Г,окисляющийся до йода 12, придающего раствору желтую окраску.
2.Реакция с серной кислотой.
Ацетат - ион в сильно кислой среде переходит в слабую уксусную кислоту, пары которой имеют характерный запах уксуса:
СН3СОО- + Н+ <- СН3СООН
Проведению реакции мешают анионы NO2\ S2-, SO32-, S2O32-, также выделяющие в среде концентрированной H2SO4 газообразные продукты с характерным запахом.
3.Реакция образования уксусноэтилового эфира (фармакопейная).
Реакцию проводят в сернокислой среде. С этанолом:
СН3СОО- + Н+ -- СН3СООН СН3СООН + С2Н5ОН = СН3СООС2Н4 + Н2О
Выделяющийся этилацетат обнаруживают по характерному приятному запаху. Соли серебра катализируют эту реакцию, поэтому при ее проведении рекомендуется добавлять небольшое количество AgNO3.
Аналогично при реакции с амиловым спиртом С5НцОН образуется также обладающий приятным запахом амилацетат СН3СООС5Ни (-грушевая-) Ощущается характерный запах этилацетата, усиливающийся при осторожном нагревании смеси.
Аналитические реакции тартрат - иона РОС- СН(ОН) - СН(ОН) - СОСТ. Тартрат- ион - анион слабой двухосновной винной кислоты:
НО-СН-СООН
НО -СН- СООН
Тартрат - ион хорошо растворим в воде. В водных растворах тартрат - ионы бесцветны, подвергаются гидролизу, склонны к комплексообразованию, давая устойчивые тартратные комплексы с катионами многих металлов. Винная кислота образует два ряда солей – средние тартраты, содержащие двух зараядный тартрат – ион СОСН(ОН)СН(ОН)СОО-, и кислые тартраты – гидротартраты, содержащие однозарядный гидротартрат – ион НОООСН(ОН)СН(ОН)СОО-. Гидротартрат калия (-винный камень-) КНС4Н4О6 практически не растворм в воде, что используется для открытия катионов калия. Средняя кальциевая соль также мало растворима в воде. Средняя калиевая соль К2С4Н4О6 хорошо растворяется в воде.
I. Реакция с хлоридом калия (фармакопейная).
С4Н4О62- + К++ Н+ -> КНС4Н4О61 (белый)
2. Реакция с резорцином в кислой среде (фармакопейная).
Тартраты при нагревании с резорцином мета - С6Н4(ОН)2 в среде концентрированной серной кислоты образуют продукты реакции вишнево - красного цвета.
14) Реакции с аммиачным комплексом серебра. Выпадает черный осадок металлического серебра.
15) Реакция с сульфатом железа (II) и пероксидом водорода.
Прибавление разбавленного водного раствора FeSO4 и Н2О2 к раствору, содержащему тартраты. приводит к образованию к образованию неустойчивого комплекса железа жатого цвета. Последующая обработка раствором щелочи NaOH приводит к кяншиовению комплекса голубого цвета.
Аналитические реакции оксалат- иона С2О42-
Оксалат- ион С2О42-- анион двухосновной щавелевой кислоты Н2С2О4 средней силы, сравнительно хорошо растворимой в воде. Оксалат- ион в водных растворах бесцветен, частично гидролизуется, сильный восстановитель, эффективный лиганд -образует устойчивые оксалатные комплексы с катионами многих металлов. Оксалаты щелочных металлов, магния и аммония растворяются в воде, а других металлов мало растворимы в воде.
1Реакция с хлоридом бария Ва2+ + С2О42- = ВаС2О4 (белый) Осадок растворяется в минеральных кислотах и в уксусной кислоте (при кипячении). 2. Реакция с хлоридом кальция (фармакопейная): Са2+ + С2О42- = СаС2О4 (белый)
Осадок растворяется в минеральных кислотах, но не растворяется в уксусной кислоте.
3. Реакция с нитратом серебра.
2 Ag+ + С2О42- —> Ag2C2O4.|.( творожистый) Проба на растворимость. Осадок делят на 3 части:
а). В первую пробирку с осадком прибавляют по каплям при перемешивании раствор HNO3 до растворения осадка;
б). Во вторую пробирку с осадком прибавляют по каплям при перемешивании концентрированный раствор аммиака до растворения осадка; в). В третью пробирку с осадком прибавляют 4-5 капель раствора НС1; в пробирке остается белый осадок хлорида серебра:
Ag2C2O4 + 2 НС1 -> 2 АС1 (белый) + Н2С2О4
4.Реакция с перманганатом калия. Оксалат ионы с КМпО4 в кислой среде окисляются с выделением СО2; раствор КМпО4 при этом обесцвечивается вследствие восстановления марганца (VII) до марганца (II):
5 С2О42- + 2 МпО4' + 16 Н+ ->• 10 СО2 + 2 Мп2+ + 8 Н2О
Разбавленный раствор КМпО4. Последний обесцвечивается; наблюдается выделение пузырьков газа - СО2.
38 Элементы группы VA
Общая характеристика VA группы Периодической системы.в виде sxpy электронная конфигурацию внешнего энергетического уровня элементов VA группы.
Мышьяк и сурьма имеют разные аллотропные модификации: как с молекулярной, так и с металлической кристаллической решеткой. Однако на основании сравнения устойчивости катионных форм (As3+, Sb3+) мышьяк относят к неметаллам, а сурьму к металлам.
степени окисления устойчивые для элементов VA группы
От азота к висмуту (с уменьшением неметаллических свойств):
w уменьшается устойчивость отрицательной степени окисления (-3) (м. свойства водородных соединений)
w уменьшается устойчивость высшей положительной степени окисления (+5)
w увеличивается устойчивость низкой положительной степени окисления (+3)
Дата добавления: 2016-02-02; просмотров: 2332;
