ФАРМАКОПЕЙНАЯ СТАТЬЯ Ионометрия
Метод ионометрии основан на измерении активности (концентрации) определяемых ионов с помощью ионоселективных (индикаторных) электродов. Ионоселективный электрод обладает избирательной чувствительностью к определенному виду ионов, от содержания которых зависит его потенциал. В основу ионометрии положен принцип потенциометрического анализа, заключающийся в измерении разности потенциалов (электродвижущей силы) индикаторного ионоселективного электрода и электрода сравнения, потенциал которого постоянен.
Зависимость электродвижущей силы электродной системы от активности потенциалопределяющего иона описывается уравнением Нернста:
| Е = Ео + 2,303 | R ∙ T | lg a , (1) |
| z ∙ F |
где Е – разность потенциалов между измерительным электродом и электродом сравнения (электродвижущей силы), мВ;
Е0 – стандартное значение электродвижущей силы при а = 1, мВ;
R – универсальная газовая постоянная, Дж/(моль∙K);
T – абсолютная температура, К;
F – число Фарадея, Кл/моль;
z – заряд определяемого иона;
а – активность или эффективная концентрация свободных ионов в растворе, связанная с концентрацией соотношением:
а = f ∙ C , (2)
где С – молярная концентрация, моль/л;
f – коэффициент активности.
Для очень разбавленных растворов коэффициент активности близок к единице и активность ионов равна концентрации.
Если коэффициент активности поддерживается постоянным, уравнение Нернста принимает вид:
Е = Е0 + 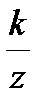 ∙ lg (f ∙ C), (3)
∙ lg (f ∙ C), (3)
где k = 2,303 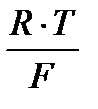 - коэффициент, который означает изменение электродвижущей силы на единицу изменения lg a, и может быть рассчитан по формуле при любой температуре:
- коэффициент, который означает изменение электродвижущей силы на единицу изменения lg a, и может быть рассчитан по формуле при любой температуре:
k = [0,05916 + 0,000198 ∙ (t – 25о С)], (4)
и приведен в табл. 1.
Таблица 1- Значения k при различных температурах
| Температура, оС | k , В |
| 0,0572 | |
| 0,0582 | |
| 0,0592 | |
| 0,0602 | |
| 0,0611 |
Коэффициент активности (f) считается постоянным, если при измерениях во всех анализируемых и калибровочных растворах поддерживается одинаковая ионная сила. Для создания постоянной ионной силы к раствору добавляют раствор индифферентного электролита (фоновый раствор) с концентрацией в 10 – 100 раз больше, чем суммарная концентрация других ионов в растворе, с тем, чтобы различные количества анализируемого иона не влияли на ионную силу раствора и коэффициент активности определяемого иона оставался постоянным.
Если Е = Е0 + 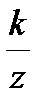 ∙ lg f = Ео´ и S =
∙ lg f = Ео´ и S = 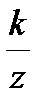 ,
,
где S – крутизна электродной функции, то:
Е = Ео´ + S lg С = Ео´ - S ∙ рС (5),
где рС = - lg С.
Таким образом, при постоянной ионной силе раствора и постоянной температуре наблюдается линейная зависимость электродвижущей силы электродной системы от концентрации определяемого иона.
Дата добавления: 2016-01-30; просмотров: 2060;
