Метод стандартных добавок
Метод применим в линейных областях калибровочной кривой.
2.1. Метод многократных добавок
В испытуемый раствор объемом V, приготовленный, как указано в фармакопейной статье, вводят несколько (не менее трех) порций объемом V0 ( V0 ≤ 0,01∙V) раствора с известной концентрацией определяемого иона, соблюдая условие неизменной ионной силы в растворе. Измеряют потенциал до и после каждой добавки и вычисляют разность ΔЕ между потенциалом, измеренным после добавки раствора с известной концентрацией, и исходным потенциалом испытуемого раствора. Полученная величина связана с концентрацией определяемого иона уравнением:
| ΔЕ = S ∙ lg (1 + | C0 ∙ V0 | ), (8) |
| C ∙ V |
или
10 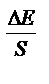 = 1 + = 1 +
| C0. ∙ V0. | , (9) |
| C ∙ V |
где V - объем испытуемого раствора, л;
C – молярная концентрация определяемого иона в испытуемом растворе, моль/л;
V0. - добавленный объем стандартного раствора, л;
C0. - концентрация определяемого иона в стандартном растворе, моль/л;
S - крутизна электродной функции, определяемая экспериментально при постоянной температуре измерением разности потенциалов двух стандартных растворов, концентрации которых отличаются в 10 раз и соответствуют линейной области калибровочной кривой, мВ.
Строят график зависимости 10 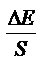 от объема добавки V0. и экстраполируют полученную прямую до пересечения с осью абсцисс. В точке пересечения концентрация испытуемого раствора определяемого иона выражается уравнением:
от объема добавки V0. и экстраполируют полученную прямую до пересечения с осью абсцисс. В точке пересечения концентрация испытуемого раствора определяемого иона выражается уравнением:
| С = | C0. ∙ V0. | , (10) |
| V |
2.2 Метод однократной добавки
К объему V испытуемого раствора, приготовленного как описано в фармакопейной статье, прибавляют объем V0. стандартного раствора с концентрацией C0.. Готовят контрольный раствор в тех же условиях. Измеряют потенциалы испытуемого и контрольного раствора до и после добавления стандартного раствора. Вычисляют концентрацию C анализируемого иона, используя следующее уравнение и делая необходимые поправки на контрольный раствор:
| С = | C0. ∙ V0. | , (11) |
10 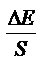 ∙ (V + V0.) - V ∙ (V + V0.) - V
|
где V - объем испытуемого или контрольного раствора, л;
C - концентрация определяемого иона в испытуемом растворе, моль/л;
V0 - добавленный объем стандартного раствора, л;
C0 - концентрация определяемого иона в стандартном растворе, моль/л;
ΔЕ - разность потенциалов, измеренных до и после добавки, мВ;
S - крутизна электродной функции, определяемая экспериментально при постоянной температуре измерением разности потенциалов двух стандартных растворов, концентрации которых отличаются в 10 раз и соответствуют линейной области калибровочной кривой, мВ.
Дата добавления: 2016-01-30; просмотров: 1833;
